температура
ТЕМПЕРАТУРА (от лат. temperatura — надлежащее смешение, нормальное состояние)
термодинамич. параметр, характеризующий состояние термич. равновесия макроскопич. системы. Наряду с давлением, хим. потенциалом и др. параметрами состояния, Т. относится к интенсивным величинам, т. к. не зависит от массы системы. Согласно принципу термич. равновесия, две фазы А и В, адиабатически изолированные от окружающей среды (внутр. энергии фаз соотв. ЕА + ЕВ = const), могут находиться в состоянии равновесия, которое характеризуется определенными значениями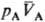 и
и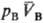 (рА, рB-давления;
(рА, рB-давления; 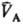 ,
, 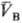 — молярные объемы фаз). Экспериментально установлено, что если фаза А находится в равновесии с фазой В, а В — с С, то А и С также находятся в равновесии. Из принципа термич. равновесия следует, что каждая фаза обладает эмпирической Т. q-измеримым свойством такого рода, что из qА(рA;
— молярные объемы фаз). Экспериментально установлено, что если фаза А находится в равновесии с фазой В, а В — с С, то А и С также находятся в равновесии. Из принципа термич. равновесия следует, что каждая фаза обладает эмпирической Т. q-измеримым свойством такого рода, что из qА(рA; 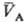 ) = qB(рB;
) = qB(рB; 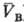 ) и qB(рB;
) и qB(рB; 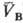 ) = qC(рC;
) = qC(рC; 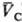 ) следует qА(pА;
) следует qА(pА; 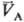 ) = qс(рс;
) = qс(рс; 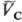 ).
).
Если две фазы с разл. q приведены в тепловой контакт друг с другом через поверхность раздела и qА > qВ, возникает поток теплоты от А к В, т. е. от более нагретой фазы к менее нагретой. При qА = qВ тепловой поток отсутствует. Принцип термич. равновесия впервые сформулирован Дж. Блэком в кон. 18 в. В термодинамику он введен, однако, позднее первого и второго начал термодинамики, поэтому его часто называют нулевым началом термодинамики.
Существует множество функций q(p, 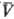 ), удовлетворяющих нулевому началу. Конкретный вид q(p,
), удовлетворяющих нулевому началу. Конкретный вид q(p, 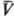 ) определяется используемым измерит. прибором-термометром и способом построения термометрич. шкалы.
) определяется используемым измерит. прибором-термометром и способом построения термометрич. шкалы.
Понятие абсолютной Т. введено У. Томсоном (лордом Кельвином) в 1848 на основании теоремы Карно, согласно которой все обратимые тепловые машины, где рабочее тело совершает круговой процесс между нагревателем с эмпирической Т. q1 и холодильником с эмпирической Т. q2, имеют одинаковый кпд η, независимо от природы рабочего тела:
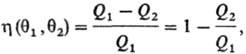
где Q1- тепло, отбираемое рабочим телом от нагревателя, Q2-тепло, передаваемое холодильнику. Значения q1 и q2 можно измерить с помощью произвольной шкалы Т., величины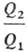 и η при смене шкалы остаются постоянными. Абсолютная Т. вводится соотношением:
и η при смене шкалы остаются постоянными. Абсолютная Т. вводится соотношением:
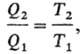
где T1 и Т2-абсолютные Т. нагревателя и холодильника соотв., причем T1 есть функция только q1, а Г2-только q2. Для построения шкалы абсолютной Т. достаточно приписать определенное значение Т, одному известному термич. состоянию. В настоящее время по международному соглашению принято, что абсолютная (термодинамич.) Т. плавления воды при нормальном давлении равна 273,15 К (точно). Абсолютный нуль Т. (или нулевая абсолютная Т.) имеют ясный физ. смысл как Т. холодильника в цикле Карно, при которой кпд тепловой машины η = 1. Тело, находящееся при нулевой Т., не способно передавать теплоту к.-л. другому телу. Единица измерения абсолютной Т. в системе СИ-градус Кельвина (Кельвин, К). Конкретные измерения абсолютной Т. осуществляются с помощью набора спец. термометров (подробнее см. термометры, термометрия).
Согласно строгой формулировке второго начала термодинамики (аксиоматика Каратеодори), абсолютная Т. вводится как интегрирующий делитель для бесконечно малого количества теплоты dQ, полученного системой, обладающей внутренней энергией Е, в обратимом процессе. Величина dQ/T является полным дифференциалом функции состояния S, наз. энтропией. Абсолютная Т. выражается соотношением:
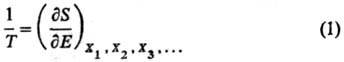
X1, X2, Х3, ...-экстенсивные термодинамич. переменные (объем V, электростатич. индукция D, магн. индукция В и т. п.). Абсолютная Т. и эмпирическая Т. q связаны аналит. зависимостью для систем, у которых E является функцией только Ти V:
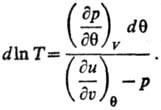
Аналит. связь p, 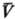 и Т для фазы наз. уравнением состояния. В статистической термодинамике аналогом уравнения (1) служит соотношение:
и Т для фазы наз. уравнением состояния. В статистической термодинамике аналогом уравнения (1) служит соотношение:
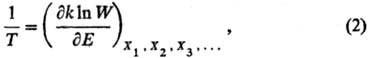
где W— термодинамич. вероятность, k-постоянная Больц-мана. Термодинамич. вероятность W(E)равна числу возможных состояний системы, при которых последняя обладает внутр. энергией Е. Термодинамич. вероятность связана с энтропией соотношением Больцмана S = kln W. Для обычной макроскопич. системы величина W- быстро возрастающая функция Е и, следовательно, абсолютная Т. положительна.
Термич. равновесие двух систем А и В (EА + ЕB = const), определяемое равенством температур TА = ТB, соответствует наиб. вероятному распределению энергии между А и В. Если В представляет собой обширный тепловой резервуар (ЕВ > EА), то абсолютная Т. определяет плотность вероятности Р(Е) для системы А находиться в состоянии с заданной энергией EA,r при термич. равновесии с системой В:
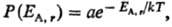
где, суммирование ведется по всем значениям 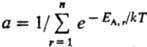 энергии EA.r (r = 1,2,... , n) подсистемы А (канонич. распределение Гиббса). Частными случаями канонич. распределения являются распределения молекул идеального газа по энергиям и скоростям (распределения Больцмана и Максвелла).
энергии EA.r (r = 1,2,... , n) подсистемы А (канонич. распределение Гиббса). Частными случаями канонич. распределения являются распределения молекул идеального газа по энергиям и скоростям (распределения Больцмана и Максвелла).
Важные физ. постоянные вещества-его Т. кипения, плавления, фазовых переходов, полиморфных превращений, а также критическая Т. (см. критическое состояние), тройные точки.
Практически все физ.-хим. величины зависят от Т. Важными примерами являются температурные зависимости:
1) константы скорости хим. реакции к:
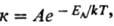
где EA-энергия активации, A-предэкспоненциальный множитель (см. Аррениуса уравнение, константа скорости, энергия активации).
2) Константы равновесия хим. реакции Kр:
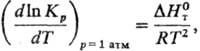
где R — газовая постоянная, 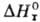 -стандартная энтальпия реакции.
-стандартная энтальпия реакции.
3) Теплового эффекта хим. реакции при постоянном давлении (ΔH) и постоянном объеме (ΔU):
(9ΔН/9Т)р = ΔСр, (9ΔU/9Т)V = ΔCV,
где H и U-энтальпия и внутр. энергия системы, Cр и CV-теплоемкости при постоянном давлении и постоянном объеме соотв. (см. Кирхгофа уравнение).
4) Теплоты равновесного фазового перехода L:
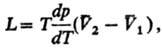
где 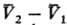 -изменение молярного объема при переходе вещества из фазы 1 в фазу 2 (см. Клапейрона — Клаузиуса уравнение).
-изменение молярного объема при переходе вещества из фазы 1 в фазу 2 (см. Клапейрона — Клаузиуса уравнение).
5) Стандартной электродвижущей силы E0 гальванич. цепи:
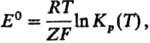
где Kр(Т)-константа равновесия электродного процесса, F-Фарадея постоянная, Z-число переносимых электронов (см. электрохимические цепи).
6) Объемной плотности ρv излучения абсолютно черного тела с частотой v (формула Планка):
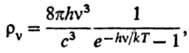
где с — скорость света, h-постоянная Планка.
Полной объемной плотности излучения по всем частотам (закон Стефана — Больцмана):
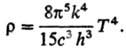
7) Степени ионизации α газа, состоящего из атомов А:
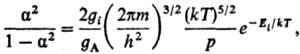
где Ei-энергия ионизации атома, m-масса электрона; gi, gА-статистич. веса ионов и атомов (уравнение Саха).
Понятие Т., сформулированное для равновесного состояния системы в целом, используется и для характеристики локального термодинамич. равновесия, если система в целом неравновесна и ее Т. рассматривается как непрерывная функция координат и времени. При локальном термодинамич. равновесии малые элементы объема приближенно рассматриваются как равновесные, обладающие каждый своей Т., и учитывается обмен энергией (энтропией) между ними. Локальное термодинамич. равновесие-одно из осн. понятий термодинамики необратимых процессов. В ряде физ. задач неравновесная система м. б. разбита на подсистемы, в которых время установления термич. равновесия много меньше времени достижения равновесия системой в целом. Подобная ситуация м. б. охарактеризована тем, что каждой из подсистем соотносится своя Т., отличная от Т. других подсистем. Например, в полупроводниках Т. электронов проводимости в сильном электрич. поле много выше Т. решетки; в плазме отдельно рассматривают Т. электронов и Т. ионов.
В нач. 50-х гг. 20 в. сформулировано понятие отрицательных абсолютных Т. Такие Т. могут возникать в системах, если с ростом энергии Е термодинамич. вероятность W (или энтропия S) не возрастает, а убывает, в результате чего производная 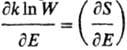 становится меньше нуля (см. формулы 1 и 2). Подобная ситуация реализуется для таких систем, в которых энергия Е ограничена снизу и сверху. Так, двухуровневая система, состоящая из N ядерных спинов во внеш. магн. поле (напр., ионы Li+ в кристалле LiF), имеет миним. энергию NE1, максимальную NE2, где E1 и Е2-энергии спина ядра на нижнем и верхнем уровнях. Начиная с энергии, равной N(E1 + E2)/2, термодинамич. вероятность W убывает с ростом энергии, что позволяет говорить об отрицательной Т. подсистемы (ионы Li+), но не для системы в целом. Рассматриваемая подсистема должна быть термически слабо связана с системой в целом, для которой отсутствуют ограничения по энергии.
становится меньше нуля (см. формулы 1 и 2). Подобная ситуация реализуется для таких систем, в которых энергия Е ограничена снизу и сверху. Так, двухуровневая система, состоящая из N ядерных спинов во внеш. магн. поле (напр., ионы Li+ в кристалле LiF), имеет миним. энергию NE1, максимальную NE2, где E1 и Е2-энергии спина ядра на нижнем и верхнем уровнях. Начиная с энергии, равной N(E1 + E2)/2, термодинамич. вероятность W убывает с ростом энергии, что позволяет говорить об отрицательной Т. подсистемы (ионы Li+), но не для системы в целом. Рассматриваемая подсистема должна быть термически слабо связана с системой в целом, для которой отсутствуют ограничения по энергии.
При физ.-хим. исследованиях условно выделяют область низких Т. (см. криохимия) и область высоких Т. (обычно 500–3000 К), которую рассматривают как химию высоких Т., или просто высокотемпературную химию. Т. в интервале 500–3000 К получают методами радиационного и лазерного нагрева, электронной и ионной бомбардировки. Объекты высокотемпературной химии, как правило, — неорг. соединения. Характерными чертами высокотемпературных хим. процессов являются: 1) сравнительно малая роль констант скорости, энергий активации и т. п. кинстич. факторов, поскольку скорость реакций высока и в системе быстро устанавливается равновесие; 2) увеличение роли газовой (паровой) фазы из-за интенсивных процессов испарения; 3) необходимость учета влияния заряженных частиц-ионов и электронов, возникающих в результате термодиссоциации (см. ионы в газах, ионно-молекулярные реакции). Высокотемпературными процессами являются мн. металлургич. производства, процессы напыления пленок, монокристаллов выращивания из газовой фазы и др.
Процессы в области Т. 3000–5000 К изучаются плазмо-химией.
Лит.: Кричевский И. Р., Понятия и основы термодинамики, 3 изд., М., 1962; Рей Ф., Статистическая термодинамика, пер. о англ., М., 1986.
М. В. Коробов
Значения в других словарях
- ТЕМПЕРАТУРА — (от лат. temperatura — надлежащее смешение, нормальное состояние), физич. величина, характеризующая состояние термодинамич. равновесия макроскопич. системы. Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Физический энциклопедический словарь
- Температура — I Температу́ра (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Большая советская энциклопедия
- температура — -ы, ж. 1. Степень нагретости чего-л. (какого-л. тела, вещества). Температура воздуха. Температура кипения воды. Колебания температуры. Поднять температуру в топке. □ Было очень холодно — температура непрерывно падала. Березко, Мирный город. Малый академический словарь
- температура — орф. температура, -ы Орфографический словарь Лопатина
- температура — Температу́р/а. Морфемно-орфографический словарь
- температура — ТЕМПЕРАТУРА - температура контрольного полоза саней. Параметр, на который ориентируется судья при проверке температуры полоза саней участников соревнований. Словарь спортивных терминов
- температура — ТЕМПЕРАТУРА ы, ж. température f., нем. Temperatur <�лат. temperatura < temperatio нормальное состояние; соразмерность. 1. Степень нагретости чего-л. БАС-1. Словарь галлицизмов русского языка
- температура — • высокая ~ • максимальная ~ Словарь русской идиоматики
- температура — Низкая температура Словарь синонимов Абрамова
- температура — сущ., ж., употр. сравн. часто (нет) чего? температуры, чему? температуре, (вижу) что? температуру, чем? температурой, о чём? о температуре; мн. что? температуры, (нет) чего? температур, чему? температурам, (вижу) что? температуры, чем?... Толковый словарь Дмитриева
- ТЕМПЕРАТУРА — • ТЕМПЕРАТУРА, в биологии — интенсивность тепла. У теплокровных (ГОМОЙОТЕРМНЫХ) животных, таких, как птицы и млекопитающие, температура тела поддерживается в узких пределах независимо от температуры окружающей среды. Научно-технический словарь
- температура — ТЕМПЕРАТУРА -ы; ж. [лат. temperatura — правильное соотношение, нормальное состояние] 1. Величина, характеризующая тепловое состояние какого-л. тела, вещества. Умеренная, средняя т. Постоянная, комнатная т. Июльская, летняя т. Ночная, дневная т. Толковый словарь Кузнецова
- температура — ТЕМПЕРАТУРА, ы, ж. 1. Величина, характеризующая тепловое состояние чего-н. Высокая, низкая т. Средняя годовая т. Т. плавления. 2. Степень теплоты тела как показатель состояния здоровья. Нормальная, повышенная т. Измерить температуру. Толковый словарь Ожегова
- температура — См. темперамент Толковый словарь Даля
- температура — Температуры, ж. [латин. temperatura]. Степень нагретости чего-н. || только ед. Степень теплоты человеческого тела как показатель состояния его здоровья. Большой словарь иностранных слов
- ТЕМПЕРАТУРА — ТЕМПЕРАТУРА (от лат. temperatura — надлежащее смешение, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия системы. Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Большой энциклопедический словарь
- температура — температура ж. 1. Величина, характеризующая тепловое состояние чего-либо. 2. Показатель теплового состояния организма человека или животного. 3. разг. Степень теплоты тела выше нормальной; жар. Толковый словарь Ефремовой
- температура — ТЕМПЕРАТ’УРА, температуры, ·жен. (·лат. temperatura). Степень нагретости чего-нибудь. Низкая температура. Высокая температура. Средняя температура страны. Температура кипения. Температура замерзания. Температура упала. Температура поднялась. | только ед. Толковый словарь Ушакова
