Кирхгофа уравнение
КИРХГОФА УРАВНЕНИЕ
термодинамич. соотношение, определяющее зависимость теплового эффекта реакции от температуры Т. Для реакции при постоянном давлении р К. у. имеет вид:
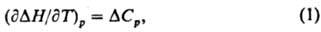
где ΔH=Qp — тепловой эффект, равный изменению энтальпии системы вследствие реакции, ΔCр — изменение теплоемкости системы. Если реакцию записать в форме где vi — стехиометрия, коэф. вещества Ai (vi>0 для продуктов 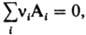 реакции, vi<0 для исходных веществ), то ΔH и ΔCр рассчитывают по формулам:
реакции, vi<0 для исходных веществ), то ΔH и ΔCр рассчитывают по формулам:
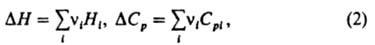
где Hi — парциальная молярная энтальпия вещества Аi, Cрi — его парциальная молярная теплоемкость; тепловой эффект относят к одному пробегу реакции, при котором число молей i-го вещества изменяется на величину vi. Значение ΔH (ΔCр) представляет разность между энтальпиями (теплоемкостями) продуктов реакции и исходных веществ, взятых в стехиометрич. соотношении. При расчетах Hi и Срi приравнивают обычно соответствующим значениям для чистого вещества Аi. Для реакции при постоянном объеме К. у. имеет вид:
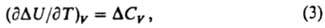
где ΔU=Qv — тепловой эффект, равный изменению внутр. энергии системы при одном пробеге реакции; 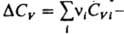 разность теплоемкостей CV продуктов реакции и исходных веществ. К. у. позволяет рассчитать тепловой эффект реакции при любой температуре Т2, если известен тепловой эффект для к.-л. одной температуры T1 и имеются данные о зависимости теплоемкостей участвующих в реакции веществ от температуры в интервале между Т1 и Т2. Интегрируя уравнение (1), получим:
разность теплоемкостей CV продуктов реакции и исходных веществ. К. у. позволяет рассчитать тепловой эффект реакции при любой температуре Т2, если известен тепловой эффект для к.-л. одной температуры T1 и имеются данные о зависимости теплоемкостей участвующих в реакции веществ от температуры в интервале между Т1 и Т2. Интегрируя уравнение (1), получим:
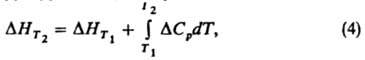
где DHT1 и ΔHT2 тепловые эффекты реакции при температурах Т1 и Т2. В частности, широко применяется след, форма уравнения (4):
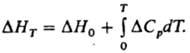
Здесь ΔH0 — гипотетич. тепловой эффект, который бы наблюдался, если бы принимаемые в расчетах температурные зависимости теплоемкости были справедливы вплоть до абс. нуля температур. Уравнение (1) применяют для приближенного определения зависимости теплот испарения и сублимации от температуры. В этих случаях ΔCр=Спарр-С*p (или Cрпар-Cртв). Однако при точных вычислениях следует учитывать, что с изменением температуры равновесное давление двухфазной системы изменяется. Уравнения (1) и (2) выведены Г. Р. Кирхгофом в 1858.
Н. А. Смирнова
Значения в других словарях
- Кирхгофа уравнение — Равенство, выражающее температурную зависимость теплового эффекта химических реакций через разность теплоемкостей конечных продуктов и исходных веществ. В частности, для реакций, происходящих при постоянном объеме, К. Большая советская энциклопедия
- КИРХГОФА УРАВНЕНИЕ — КИРХГОФА УРАВНЕНИЕ — соотношение, устанавливающее зависимость теплового эффекта химической реакции от температуры. Позволяет определять тепловой эффект реакции при любой температуре по стандартным энтальпиям (теплотам) образования... Большой энциклопедический словарь
