константа скорости
КОНСТАНТА СКОРОСТИ реакции
коэффициент пропорциональности в кинетич. уравнении хим. реакции, выражающем зависимость скорости реакции v от концентрации к.-л. из компонентов реакц. смеси. Для бимолекулярных реакций типа vAA+vBB: продукты, протекающих при постоянном объеме, согласно действующих масс закону, 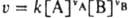 , где vA и vB — стехиометрич. коэф. реагирующих веществ А и В, k — константа скорости; численно k=v при [А]=[В]=1 моль/л. Для мономолекулярных реакций К. с. имеет размерность с−1, для бимолекулярных — л/моль∙с, для тримолекулярных — л2/моль2.с. Помимо истинной К. с. часто имеют дело с эффективной К. с. kэфф в рассматриваемом эксперименте; если, напр., бимолекулярная реакция между А и В происходит при большом избытке вещества В и концентрация [В] практически не меняется, кинетич. уравнение реакции м. б. записано в виде:
, где vA и vB — стехиометрич. коэф. реагирующих веществ А и В, k — константа скорости; численно k=v при [А]=[В]=1 моль/л. Для мономолекулярных реакций К. с. имеет размерность с−1, для бимолекулярных — л/моль∙с, для тримолекулярных — л2/моль2.с. Помимо истинной К. с. часто имеют дело с эффективной К. с. kэфф в рассматриваемом эксперименте; если, напр., бимолекулярная реакция между А и В происходит при большом избытке вещества В и концентрация [В] практически не меняется, кинетич. уравнение реакции м. б. записано в виде:
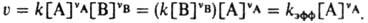
Для сложных реакций, протекающих в неск. стадий, часто скорость реакции не м. б. представлена как простая пропорциональная зависимость v от концентрации реагентов и выражается более сложным уравнением, напр.: v=k'[A][B](l+k:[В])−1; тогда k' и k: наз. коэффициентами в уравнении для скорости реакции. Если скорость сложной реакции м. б. выражена через произведение концентраций реагентов, то коэф. пропорциональности k наз. коэффициентом скорости или эффективной К.с. Если реакция между А и В протекает на поверхности (напр., катализатора) и ее скорость v~[А][В]S (S — площадь поверхности), то k = v/[A][В]S чаще всего рассматривают как эмпирическую (кажущуюся) К. с. Зависимость К. с. от температуры Г выражается Аррениуса уравнением: k=Aехр(-E/RT), где А — предэкспоненц. множитель, Е — энергия активации реакции, R — газовая постоянная. Значения К. с. изменяются с температурой в широких пределах, напр. для бимолекулярных реакций — от 1010 до 10−10 л/моль∙с. К. с. — фундам. кинетич. характеристика реакции в данных условиях (фаза, среда, температура, давление), не зависящая от концентраций реагентов. Нахождение К. с. из эксперим. данных наз. обратной задачей хим. кинетики; использование известных К. с. для расчета концентраций компонентов реакц. смеси в данный момент времени (при известных начальных концентрациях) в хим. кинетике наз. прямой задачей.
Лит. см. при ст. кинетика химическая.
Е. Т. Денисов
