титан
ТИТАН (Titanium) Ti
хим. элемент IV гр. периодической системы, ат. н. 22, ат. м. 47,88. В природе пять стабильных изотопов: 46Ti (7,95%), 47Ti (7,75%), 48Ti (73,45%), 49Ti (5,51%), 50Ti (5,34%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 5,6∙10−28м2. Конфигурация внеш. электронных оболочек атома 3d24s2; степени окисления + 4 (наиб. характерна), +3 и +2; энергия ионизации при последоват. переходе от Ti0 к Ti4+ равна соотв. 6,82, 13,58, 27,47, 43,24 эВ; сродство к электрону 0,39 эВ; электроотрицательность по Полингу 1,5; атомный радиус 0,149 нм, ковалентный радиус 0,132 нм, ионные радиусы, нм (в скобках указаны координац. числа) Ti4+ 0,056 (4), 0,065 (5), 0,0745 (6), 0,088 (8), Ti3+ 0,081 (6), Ti2+ 0,100 (6).
Содержание Т. в земной коре 0,57% по массе. По распространенности в природе занимает 10-е место; в своб. виде не встречается. Важнейшие минералы (известно св. 100): рутил TiO2 (более редкие кристаллич. модификации — анатаз и брукит), ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит СаTiO3 и титанит (сфен) CaTiOSiO4.
Руды Т., имеющие пром. значение, разделяются на две осн. группы: коренные — ильменит-титано-магнетитовые; россыпные-рутил-ильменит-цирконовые. Крупные коренные месторождения ильменита и титаномагнетитов находятся в Канаде, США, Норвегии, Швеции, ЮАР, Египте, Индии, Австралии, СНГ. Общие запасы коренных месторождений оценивают в 600 млн. т по содержанию Т. Россыпные руды имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии.
Свойства. Т. — серебристо-белый легкий металл; существует в двух кристаллич. модификациях: α-Ti с гексагон. шютноупакованной решеткой, а = 0,2951 нм, с = 0,4697 нм, 2 = 2, пространственная группа С6ттс; β-Ti с кубич. объемно-центрир. решеткой, а = 0,3269 нм, z = 2, пространственная группа Iт3т; температура перехода α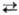 β 883 °C, ΔH перехода 3,8 кДж/моль. Т. пл. 1671 °C, т. кил. 3260 °C; плотн. α-Ti и β-Ti равна соотв. 4,505 (20 °C) и 4,32 (900 °C) г/см3;
β 883 °C, ΔH перехода 3,8 кДж/моль. Т. пл. 1671 °C, т. кил. 3260 °C; плотн. α-Ti и β-Ti равна соотв. 4,505 (20 °C) и 4,32 (900 °C) г/см3; 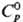 25,1 Дж/(моль∙К);
25,1 Дж/(моль∙К); 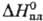 14,6 кДж/моль,
14,6 кДж/моль, 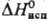 397 кДж/моль;
397 кДж/моль; 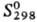 30,7 Дж/(моль∙К); температура перехода в сверхпроводящее состояние 0,42 К; уравнение температурной зависимости давления пара: lgp(кПа) = 5,7904–24644/T-0,0002277; температурный коэф. линейного расширения 8,2∙10−6 К−1 (20–300 °C); теплопроводность 21,9 Вт/(м∙К) (300 К); ρ 0,42 мкОм∙м (20 °C), 1,80 мкОм∙м (800 °C); парамагнетик, удлмагн. восприимчивость +3,2∙10−6 (20 °C); постоянная Холла α-Ti +1,82∙10−13. Т. обладает высокими мех. характеристиками, сравнительно слабо зависящими от температуры и сильно — от чистоты и способов предварит. обработки. Для высокочистого, отожженного в вакууме Т. араст 240–260 МПа, предел текучести 140–170 МПа, относит. удлинение 55–70%, модуль упругости 96–106 ГПа, твердость по Бринеллю 175 МПа.
30,7 Дж/(моль∙К); температура перехода в сверхпроводящее состояние 0,42 К; уравнение температурной зависимости давления пара: lgp(кПа) = 5,7904–24644/T-0,0002277; температурный коэф. линейного расширения 8,2∙10−6 К−1 (20–300 °C); теплопроводность 21,9 Вт/(м∙К) (300 К); ρ 0,42 мкОм∙м (20 °C), 1,80 мкОм∙м (800 °C); парамагнетик, удлмагн. восприимчивость +3,2∙10−6 (20 °C); постоянная Холла α-Ti +1,82∙10−13. Т. обладает высокими мех. характеристиками, сравнительно слабо зависящими от температуры и сильно — от чистоты и способов предварит. обработки. Для высокочистого, отожженного в вакууме Т. араст 240–260 МПа, предел текучести 140–170 МПа, относит. удлинение 55–70%, модуль упругости 96–106 ГПа, твердость по Бринеллю 175 МПа.
Стандартный электродный потенциал Ti0/Ti3+ −1,63 В, Ti3+/Ti4+ —0,20 В. На воздухе Т. покрывается защитной оксидонитридной пленкой, обусловливающей его высокую коррозионную стойкость к воздуху (до 500 °C), морской воде, разб. растворам H2SO4, HCl и щелочей, растворам хлоридов и влажному Cl2. В HNO3 T. пассивируется. Реагирует с конц. соляной и серной кислотами при 25 °C, с горячими трихлор- и трифторуксусными кислотами, горячими конц. фосфорной, щавелевой и муравьиной кислотами. Фтористоводородная кислота с Т. независимо от концентрации реагирует при 25 °C, присутствие фторид-ионов способствует растворению Т. и в др. кислотах из-за образования комплексного аниона [TiF6]2−. В конц. растворах щелочей порошок Т. раств. с выделением H2 и образованием солей ортотитановой кислоты TiO2∙2H2O.
При 1200 °C компактный Т. загорается на воздухе и в атмосфере N2. Стружка и порошок Т. парофорны. В системе Ti-O установлено существование фаз TiOx с областью гомогенности x = 0,60–1,26, Ti2O3 (Ti2O2x, x = 1,42–1,57), TiO2 (TiOx, x = 1,98–2,0; см. титана оксиды). Гидроксид ТЮ(OH)2 ∙ хH2O м. б. осажден NH3 и др. основаниями из растворов солей Т., разложением титанатов щелочных металлов разб. кислотами и гидролизом растворов, содержащих Ti(FV).
В соед. с галогенами Т. проявляет степени окисления +4, +3, +2 и очень редко +1, связь Ti—X преим. ковалентная, ее полярность возрастает с увеличением радиуса галогена (см. титана галогениды).
Соед. Ti с др. неметаллами чаще всего относятся к соед. внедрения атомов неметаллов малых размеров (Н, В, С, N, О, Si) в междоузлия решетки Ti. В системе Ti — H обнаружен ряд твердых растворов и гидрид переменного состава TiH1+x (x = 1,0–1,98)-серое аморфное вещество; получают восстановлением TiO2 гидридом Ca, применяют для получения очень чистого H2. При натр. смеси TiO2 с сажей при 1900–2000 °C в атмосфере H2 образуется титана карбид TiC, при взаимодействии порошка Т. с N2 при 800–1000 °C или TiCl4 с NH3 при нагр. получают титана нитрид TiN. Спеканием порошков Т. и Si в вакууме или алюмотермич. восстановлением смеси TiO2 с SiO2 получены силициды: Ti5Si13, TiSi и TiSi2. Спеканием порошков Ti и В в атмосфере Ar при 2000 °C или в вакууме при 1800—2000 °C выделены бориды: Ti2B, TiB2 и TiB (изоморфен TiC, TiN и TiO, образует с ними непрерывные твердые растворы). Для Т. известны сульфиды, селениды и теллуриды. Т. образует соли с кислородсодержащими кислотами -титана сульфаты, нитраты, фосфаты и др. С оксидами элементов I, II, III гр. периодической системы TiO2 дает многочисл. титанаты, многие из которых обладают сегнето-электрич. свойствами и высокими диэлектрич. постоянными.
• см. также титанорганические соединения
Т. образует сплавы со всеми металлами, кроме щел.-зем. и щелочных. Большинство металлов при растворении в Т. понижает температуру перехода α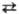 β и стабилизирует β-фазу.
β и стабилизирует β-фазу.
Получение. Ильменитовые концентраты, содержащие 40–62% TiO2 и 40–48% FeO + Fe2O3, чаще всего подвергают либо сернокислотной, либо пирометаллургич. переработке. В первом случае концентраты разлагают H2SO4, выщелачивают водой и гидролизуют образовавшиеся окси-сульфаты Т.; получают гидроксид Ti, который прокаливают до TiO2. Побочный продукт — FeSO4 ∙ 7H2O.
Пирометаллургич. переработка состоит в восстановит. плавке ильменитовых концентратов с коксом или антрацитом и послед. хлорировании титанового шлака (содержит 80–85% TiO2); затем проводят очистку TiCl4, его восстановление с получением титановой губки, переплавку губки и рафинирование металла. Алюмотермич. восстановлением ильменитовых концентратов получают ферротитан.
Восстановит. плавку ильменитовых концентратов ведут в электродуговых печах при 1600–1700 °C, загружая в печи брикетированную или порошкообразную шихту и получая два продукта-чугун и титановый шлак. Извлечение Т. в шлак составляет 96,0–98,5%, Fe в чугун-96–97%, расход электроэнергии на 1 т шлака 1900–2100 кВт∙ч. Состав шлака: 82–87% TiO2,2,7–6,5% FeO, 2,8–5,6% SiO2, 2–6% Al2O3, 2–6% MgO, а также CaO, MnO, Cr2O3 и др. Хлорирование TiO2, титановых шлаков и др. титансодержащих продуктов проводят ок. 900—1000 °C в шахтных печах, реакторах с солевым расплавом или реакторах кипящего слоя. К исходному продукту добавляют кокс, который связывает кислород оксидов в смесь CO и CO2 и влияет на равновесие процесса. Перед хлорированием в шахтных печах титановые концентраты или шлаки смешивают с нефтяным коксом (20–25% в шихте) и связующими, брикетируют и прокаливают брикеты при 800–850 °C.
Хлорирование в расплаве, содержащем KCl, NaCl, CaCl2, MgCl2 и небольшие количества др. хлоридов, не требует брикетирования порошкообразной шихты; уд. производительность реакторов выше, чем шахтных печей.
Реакц. газы из хлораторов направляют на очистку в солевых фильтрах (примеси FeCl3, AlCl3, некоторых оксихлоридов образуют с NaCl и KCl легкоплавкие хлорометаллаты), а затем на конденсацию TiCl4. Очищают TiCl4 ректификацией (от некоторых примесей-их селективным восстановлением).
Восстанавливают TiCl4 обычно магниетермически (процесс Кролля). Таким путем получают ок. 80% всего Т. Применяют спец. герметичные реторты, рассчитанные на одноврем. получение от 1 до 10 т Ti, с суточной производительностью до 140 т. TiCl4 подают в реторту непрерывно или периодически, одновременно сливая накопившийся рас-плавл. MgCl2. По завершении процесса реторту охлаждают, извлекают и очищают полученный пористый Т. — титановую губку (напр., длит. отгонкой избытка Mg и оставшегося MgCl2 в вакууме при 900 °C; см. также металлотермия).
Применяют также натриетермич. восстановление TiCl4 с послед. отмывкой губки от NaCl слабым раствором HCl. Получаемый при этом порошкообразный Т. переплавляют. Описано восстановление TiO2 с помощью Ca, а также CaH2.
Рафинируют Т. электролитически или иодидным способом (с промежут. образованием TiI4), для получения слитков используют дуговую, электроннолучевую или плазменную переплавку. Масса слитков Т. достигает 4–9 т.
Сульфатная и пирометаллургич. схемы могут совмещаться. Так, титановые шлаки после восстановит. плавки ильменитовых концентратов м. б. подвергнуты сульфатизации.
Разрабатываются процессы непосредств. хлорирования ильменитовых концентратов, фторидной переработки титанового сырья, получения искусств. рутила из ильменитовых концентратов, электролитич. производства Т. из TiCl4 в расплаве хлоридов, плазмохим. восстановления TiCl4 и др.
Определение. Щелочи, NH3 и (NH4)2S на холоду осаждают из растворов Ti(IV) в виде Ti(OH)4. Титансодержащие анализируемые материалы переводят в раствор действием фтористоводородной кислоты или H2SO4 с добавкой HF, сплавлением с NaOH или с его смесью с Na2CO3 или Na2O2, а также с Na2S2O7. Отделяют Т. от др. элементов действием H2S в виннокислой среде, купферона, салициловой кислоты, NaOH. Наиб. важные методы определения Т. — колориметрический, основанный на реакции с H2O2, и объемный, заключающийся в восстановлении Т. цинком и послед. титровании KMnO4. Гравиметрич. методы (весовая форма — прокаленный TiO2) основан на осаждении щелочами, сульфидами щелочных металлов, купфероном и др., их используют для анализа простых продуктов.
Применение. Т. используют в осн. для получения легких прочных сплавов с Al, V, Mo, Mn, Cr и др. (см. титана сплавы). В странах Запада и в Японии наиб. распространение получил сплав Ti-Al-V, на производство которого идет до 50% Т. Чистый Т. в виде кованы деталей, ленты, проволоки и др. применяют в электровакуумной технике для изготовления анодов, сеток и др. деталей, в виде порошка — в качестве газопоглотителя (геттера). С целью защиты от коррозии Т. покрывают поверхности стальных изделий. Ферротитан (содержит 18–25% Ti) применяют для раскисления стали и удаления растворенных в ней кислорода, азота и серы. Присадки Т. вводят в разл. (марганцовистые, хромистые, хро-момолибденовые, хромоникелевые и др.) спец. стали, медные и алюминиевые сплавы.
В 80-х гг. в развитых странах ок. 60–65% Т. использовали в ракето- и самолетостроении, 15% в хим. машиностроении, 10% в энергетике, 8% в кораблестроении и для опреснителей морской воды.
Гидрид Т. служит лаб. источником чистого H2; K2TiF6 используют при переплавке А1 и его сплавов для получения слитков с тонкой структурой зерен и лучшими мех. свойствами, а также для получения лигатур Al-Ti и Al-Ti-B. Слоистый дисульфид TiS2-перспективный материал для катодов хим. источников тока с Li-анодом, борид TiB2-материал для плавки Be и др. металлов, электродов для плавки А1.
Мировое производство Т. (без СНГ) 30 тыс. т/год.
Т. открыл в 1790 У. Грегор в виде TiO2.
Лит.: Горощенко Я.Г., Химия титана, ч. 1–2, К., 1970–72; Лучин-ский Г. П., Химия титана, М., 1971; Сергеев В. В., Безукладников А. Б., Мальшин В.М., Металлургия титана, М., 1979; Титан. Свойства, сырьевая база, физико-химические основы и способы получения, М., 1983; Clark R. J. H., в кн.: Bradley D.C., Thornton P., Zirconium and hafnium, N.Y.-[a.o.], 1975; "Atomic Energy Review", 1983, spec, issue, № 9; Titanium: science and technology. Proc. 5th Int Conf., Munich, sept 10–14, 1984, v. 1–5, 1985.
Н. Э. Раков
Значения в других словарях
- Титан — I Тита́н (лат. Titanium) Ti, химический элемент IV группы периодической системы Менделеева; атомный номер 22, атомная масса 47,90; имеет серебристо-белый цвет, относится к лёгким металлам (См. Лёгкие металлы). Природный... Большая советская энциклопедия
- титан — -а, м. 1. В древнегреческой мифологии: божество, один из сыновей Урана и Геи, побежденных Зевсом и низвергнутых им в Тартар. Гроза росла ---. Никогда И сам Зевес с Олимпа в мир наш дольний Не извергал таких громов, когда С титанами боролся. Малый академический словарь
- титан — Ti, серебристо-серый прочный и пластичный металл, химический элемент IV группы периодической системы, ат. н. 22, ат. масса 47.88. По виду похож на сталь; плотность 4500 кг/мі, температура плавления 1671 °C. Техника. Современная энциклопедия
- титан — орф. титан, -а Орфографический словарь Лопатина
- титан — Тита́н/. Морфемно-орфографический словарь
- Титан — Самый большой спутник Сатурна и второй по величине (после Ганимеда) естественный спутник в Солнечной системе. Был открыт в 1655 г. Кристианом Гюйгенсом. Большой астрономический словарь
- титан — I. ТИТАН I а, м. titan m., нем. Titan <�гр. 1. В греческой мифологии — одно из божеств старшего поколения, детей Урана и Геи, восставших против олимпийцев. БАС-1. Борьба титанов и олимпийцев. Уш. 1940. 2. перен. Словарь галлицизмов русского языка
- титан — см. >> великан Словарь синонимов Абрамова
- титан — титан , -а Орфографический словарь. Одно Н или два?
- Титан — • Titan см. Ἣλιος, Гелиос. Словарь классических древностей
- ТИТАН — • ТИТАН (символ Ti), блестящий серебристо-белый ПЕРЕХОДНОЙ ЭЛЕМЕНТ. Открыт в 1791 г. Этот широко распространенный элемент обнаружен во многих минералах, но основными его источниками являются ИЛЬМЕНИТ и РУТИЛ. Научно-технический словарь
- Титан — Ti (от греч. Titanes — титаны; лат. Titanium * a. titanium; н. Titan; ф. titane; и. titanio), — хим. элемент IV группы периодич. системы Менделеева, ат. н. 22, ат. м. 47,88. Природный... Горная энциклопедия
- титан — ТИТАН -а; м. [греч. Titan] 1. обычно чего. О человеке, выдающемся в какой-л. области, отличающемся исключительной силой ума, таланта, величием деятельности. Титаны научной мысли. Титаны духа. Пушкин — т. русской поэзии. Толковый словарь Кузнецова
- титан — 1. ТИТАН1, а, м. 1. В древнегреческой мифологии: один из богов старшего поколения сыновей Урана и Геи, вступивших в борьбу с богами младшего поколения (олимпийцами) и побеждённых ими. Древние титаны. Поражение титанов. Толковый словарь Ожегова
- титан — ТИТАН металл, открытый химиками, рудожелтый. Титановый шерл, рутиль. Титанистое железо. Толковый словарь Даля
- титан — Титана, м. [греч. titanos]. 1. В греч. мифологии – божество из числа возглавлявшихся Кроносом гигантов, к-рые были побеждены и низвергнуты в тартар (преисподнюю) богами-олимпийцами, возглавлявшимися Зевсом. Большой словарь иностранных слов
- ТИТАН — ТИТАН — спутник Сатурна, открыт Х. Гюйгенсом (1655). Расстояние от Сатурна 1 221 860 км, сидерический период обращения 15 сут 23 ч 15 мин, диаметр 5150 км (один из крупнейших спутников планет). Имеет атмосферу, состоящую из азота с примесью метана и др. Большой энциклопедический словарь
- титан — 1. титан I м. Человек, отличающийся исключительной силой ума, таланта, выдающийся в какой-либо области знания или деятельности. II м. Химический элемент, серебристо-белый лёгкий и твёрдый металл, используемый в самолетостроении, судостроении и т.п. III... Толковый словарь Ефремовой
- титан — ТИТ’АН, титана, ·муж. (·греч. titanos). 1. В ·греч. мифологии — божество из числа возглавлявшихся Кроносом гигантов, которые были побеждены и низвергнуты в тартар (преисподнюю) богами-олимпийцами, возглавлявшимися Зевсом. Борьба титанов и олимпийцев. Толковый словарь Ушакова
- Титан — (хим.; Titan нем., Titane франц., Titanium англ.; Ti = 48,1, если O = 16) — четвертый элемент первого большого периода периодической системы, начинающегося с калия. Энциклопедический словарь Брокгауза и Ефрона
