металлотермия
МЕТАЛЛОТЕРМИЯ
процессы получения металлов, основанные на восстановлении их оксидов и галогенидов другими, более активными металлами; протекают с выделением тепла. С помощью М. получают такие металлы, как, напр., Ti, U, РЗЭ, Nb, Ta, безуглеродистые сплавы, отличающиеся высокой чистотой (гл. обр. по углероду). Высокая чистота конечных продуктов металлотермич. восстановления обусловливает, напр., высокую пластичность полученных металлов, т. к. содержание мн. примесей в них, в первую очередь примесей внедрения, на очень низком уровне.
Металлотермич. процессы инициируются теплом. Исходным соед. для М. в осн. служат оксиды, хлориды и фториды. Хлориды и фториды обычно используют в тех случаях, когда содержание кислорода в получаемом металле (напр., Ti) должно быть ограничено либо разделение металлич. и шлаковой оксидной фаз затруднено из-за высокой хим. активности восстановленных металлов (РЗЭ). Осн. требования к исходному соед. — высокое тепловыделение при восстановлении, простота и полнота отделения исходного соед. от получаемого металла.
Реакция металлотермич. восстановления MX + М'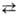 М + М'Х протекает слева направо при условии более высокого сродства металла-восстановителя (М') к компоненту X, чем у восстанавливаемого металла (М); DG0 металлотермич. процесса, как правило, отрицательна. В качестве восстановителей могут использоваться лишь металлы, образующие термически стойкие соед. с О, Cl, F.
М + М'Х протекает слева направо при условии более высокого сродства металла-восстановителя (М') к компоненту X, чем у восстанавливаемого металла (М); DG0 металлотермич. процесса, как правило, отрицательна. В качестве восстановителей могут использоваться лишь металлы, образующие термически стойкие соед. с О, Cl, F.
На рис. 1 представлены диаграммы зависимости величин DG0обр оксидов, хлоридов и фторидов из простых веществ от температуры, из которых видно, что среди относительно распространенных и доступных металлов наиб. прочные оксиды и галогениды образуют Al, Mg, Ca, а также щелочные металлы. Поэтому наиболее распространенные восстановители в M.-Na (реже Li), Al, Mg, Ca, иногда La и др. металлы. Соотв. М. подразделяют на натриетермию, алюминотермию, магниетермию и т. д.; к М. условно относят также и силикотермию.
Для сдвига равновесия металлотермич. восстановления и повышения теплового эффекта реакции (как, напр., в случае восстановления алюминием CaO или ThO2, имеющих большее, чем у Al2O3, абс. значение величины DG0обр) используют спец. приемы — вводят добавки (напр., Si) для связывания выделяющегося металла и получают в качестве конечного продукта не индивидуальный металл, а прочный металлид (напр., силициды РЗЭ), проводят М. в вакууме, вводят добавки для связывания компонентов шлака в прочные соед. (напр., Al2O3 — в алюминаты при алюминотермии). Так, DG0обр силицидов РЗЭ составляет ок. −270 кДж/моль, поэтому DG0 реакции алюминотермич. восстановления оксидов РЗЭ в присутствии Si становится величиной отрицательной (рис. 2).
При проведении М. в вакууме восстанавливаемый металл переходит в пар, сдвигая тем самым равновесие реакции вправо. Величина этого сдвига возрастает с повышением температуры и понижением давления в системе и составляет 100–150 кДж в интервале температур 1000–2000 К и давлении 1 Па. Например, силикотермич. восстановление MgO (эндотермич. реакции 2MgO + Si 2Mgпар + SiO2) может протекать с образованием Mg при обычном давлении выше 2400 К, а в вакууме при 1600 К.
2Mgпар + SiO2) может протекать с образованием Mg при обычном давлении выше 2400 К, а в вакууме при 1600 К.
Механизм металлотермич. восстановления изучен недостаточно. Гетерог. реакции М. протекают, как правило, между жидкой и твердой (напр., алюминотермич. восстановление оксидов) или жидкой и паровой фазами (магниетермич. восстановление TiCl4). Часто реагенты находятся в двух агрегатных состояниях; напр., Ca при кальциетермии реагирует как в жидком, так и в парообразном состоянии.
Среди металлотермич. процессов наиб. распространена алюминотермия. Этим методом получают сплавы большинства технически важных металлов (Nb, Ti, W, Zr, РЗЭ, Cr, Ba, Ca, V, Ta, Sr), которые используют для легирования сталей, чугунов и цветных металлов и как исходные материалы для производства самих металлов. Алюминотермич. процессы подразделяют на 3 осн. группы: процессы, в которых благодаря экзотермич. эффекту реакции выделяется тепла больше, чем необходимо для нормального протекания реакции (расплавления всех компонентов, разделения металлич. и шлаковой фаз в результате разности в плотностях расплавов); процессы, в которых тепла выделяется больше, чем необходимо для расплавления продуктов реакции, но недостаточно для покрытия тепловых потерь; процессы, в которых тепло выделяется в недостаточном количестве для расплавления продуктов реакции.
Процессы первой группы проводят внепечным методом. Перемешанную шихту загружают в горн и поджигают запалом из стружки Mg. Плавку проводят как с выпуском металла, так и без (плавка на "блок"). Средняя продолжительность такого процесса (на 4–6 т шихты) 15–20 мин. Степень извлечения металла ок. 70–80%. Шлак и металл разделяют либо механически после остывания, либо путем раздельного выпуска. Внепечным методом получают легковосстанавливаемые металлы (V, Nb и др.), а также лигатуры, содержащие относительно трудновосстанавливаемые металлы.
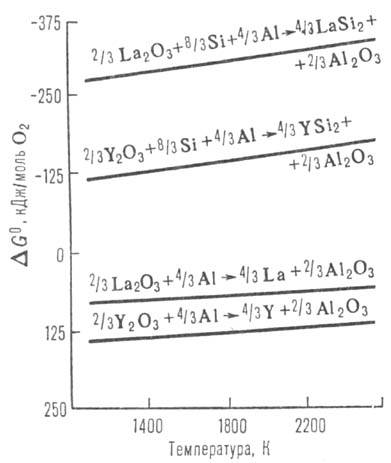
Рис. 2. Температурная зависимость DG0 восстановления оксидов La и Y алюминием.
Процессы второй группы проводят также в горне. Дополнит. тепло, необходимое гл. обр. для компенсации потерь на нагрев стенок горна, получают путем введения термитных добавок-смесей порошка Al с оксидами металлов (напр., NiO), при взаимодействии которых выделяется большое количество тепла.
Процессы третьей группы проводят в электропечах, гл. обр. в дуговых сталеплавильного типа. Так, напр., лигатуры, содержащие РЗЭ, выплавляют в наклоняющейся дуговой печи. Печь разогревают до 1700–1750 °C, зажигают дугу и загружают шихту. После плавления шихты и выдержки расплав сливают в изложницу, из которой после отстоя и кристаллизации шлака производят выпуск лигатуры.
М а г н и е т е р м и я получила свое развитие в связи с производством U путем восстановления магнием UF4, а также в связи с организацией пром. производства Ti. Восстановление очищенного TiCl4 проводят в инертной атмосфере в герметичных ретортных печах с электрич. и др. видами нагрева. Производительность совр. печей ок. 4 т за один рабочий цикл. В реторту подают расплавл. Mg спец. дозатором, а затем после достижения 740–780 °C-TiCl4; периодически производят слив MgCl2 через спец. отверстия в ниж. части реторты. Процесс оканчивают, когда израсходовано 60–70% Mg; остальной восстановитель располагается в порах образовавшейся титановой губки, что затрудняет его контакт с TiCl4. Реакц. масса содержит 50–70% титановой губки, 30–35% Mg и 15–20% MgCl2; ее разделяют вакуумной сепарацией, нагревая до 1100 °C. Отгоняющиеся Mg и MgCl2 собирают в конденсаторе, представляющем собой также реторту, устанавливаемую сверху и охлаждаемую водой. После охлаждения титановую губку извлекают, а верх. реторту (конденсатор) догружают Mg и используют для след. восстановления (т. наз. оборотная реторта). Магниетермия перспективна также для получения Zr, Nb и др. металлов.
Наиб. активный восстановитель — Ca. Кальциетермией получают U, Zr, Hf, Ti, РЗЭ. Т.к. применение оксидов и хлоридов U и РЗЭ затруднено, то в качестве исходного соед. для восстановления используют их безводные фториды. Кальций загружают в виде стружки. Процесс проводят до расплавления всех компонентов при температуре до 1800 °C в герметичных электропечах и инертной атмосфере. Разделение металлич. и шлаковой фаз происходит в результате различия в их плотностях.
При кальциетермич. получении тонкодисперсных порошков Zr, Hf и Ti восстанавливают их оксиды при температуре ок. 1100 °C. Шлак отделяют путем растворения CaO в кислотах. Для удобства диспергирования Ca часто используют в виде хрупкого гидрида CaH2, который перед смешением с оксидами измельчают. Этот процесс применяют для производства порошков магн. материалов SmCo5 и Nd-Fe-B.
М. открыл Н. Н. Бекетов, в 1859–65 он показал, что Al при высоких температурах восстанавливает оксиды металлов (CaO, BaO и др.) до металлов.
Лит.: Вольский А. Н., Сергиевская Е. М., Теория металлургических процессов, М., 1968; Самсонов Г. В., Перминов В. П., Магниетермия, М., 1971; Алюминотермия, М., 1978; Михайличенко А. И., Михлин Е. Б., Патрикеев Ю. Б., Редкоземельные металлы, М., 1987.
Ю. Б. Патрикеев
Значения в других словарях
- металлотермия — Процесс получения металлов восстановлением из оксидов, хлоридов, фторидов, комплексных соединений другими металлами (алюминий, магний, кальций, натрий). Металл-восстановитель должен быть активным, т. Техника. Современная энциклопедия
- Металлотермия — (от Металлы и греч. thérme — теплота) процессы, основанные на восстановлении металлов из их соединений (окислов, галлоидов и др.) более активными металлами (алюминием, магнием, кремнием, условно принимаемым за металл, и др. Большая советская энциклопедия
- металлотермия — орф. металлотермия, -и Орфографический словарь Лопатина
- МЕТАЛЛОТЕРМИЯ — МЕТАЛЛОТЕРМИЯ (от металлы и греч. therme — жар, тепло) — металлургические процессы, основанные на восстановлении металлов из их соединений (оксидов, галогенидов и др.) более активными металлами и протекающие с выделением теплоты (напр. Большой энциклопедический словарь
