кинетика химическая
КИНЕТИКА ХИМИЧЕСКАЯ (от греч. kinetikos — движущий)
раздел физ. химии, изучающий химическую реакцию как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. К. х. устанавливает временные закономерности протекания хим. реакций, связь между скоростью реакции и условиями ее проведения, выявляет факторы, влияющие на скорость и направление хим. реакций. Изучить механизм сложного хим. процесса — означает выяснить, из каких элементарных стадий он состоит и каким образом элементарные стадии связаны друг с другом, какие образуются промежут. продукты и т. п.
Теоретич. К. х. занимается построением мат. моделей сложных хим. процессов, анализом этих моделей в сопоставлении с эксперим. данными. Важной задачей К. х. является изучение элементарных реакций с участием активных частиц: своб. атомов и радикалов, ионов и ион-радикалов, возбужденных молекул и др. Используя результаты кинетич. исследований и изучения строения молекул и хим. связи, К. х. устанавливает связь между строением молекул реагентов и их реакц. способностью.
Динамика элементарного акта изучает теоретич. и эксперимент. методами элементарный акт хим. реакции и предшествующие ему механизмы возбуждения реагирующих частиц. Кинетич. исследования входят как важная составная часть во многие самостоят, разделы химии, такие, как катализ, фотохимия, плазмохимия, радиационная химия, электрохимия и др. В своих методах исследования и теоретич. обобщениях К. х. использует достижения математики, кибернетики, атомной и мол. физики, квантовой химии, спектроскопии, аналит. химии. Кинетич. данные и теоретич. концепции К. х. используются при создании экологич. моделей атмосферы и гидросферы, при анализе процессов, происходящих в космосе.
Основные понятия К. х. Любая химическая реакция представляет собой совокупность элементарных актов хим. превращения. Каждый такой акт есть превращение одной или неск. находящихся в контакте или взаимодействии частиц реагентов в частицы продуктов. Простые реакции состоят из однотипных элементарных актов. В зависимости от числа частиц, принимающих участие в реакции, они делятся на мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции. Реакции, при протекании которых осуществляются разнотипные элементарные акты, наз. сложными реакциями. К ним относятся обратимые, параллельные, последовательные и др. многостадийные реакции, цепные реакции, сопряженные реакции и др.
За развитием хим. реакций следят по изменению концентраций реагирующих веществ и (или) продуктов, опытные данные представляют графически в виде кинетич. кривых концентрация время t (см. кинетическое уравнение). Путем дифференцирования кинетич. кривой для реагента А получают скорость изменения его концентрации vА=-d[A]/dt. Скорость реакции, согласно действующих масс закону, прямо пропорциональна произведению концентраций ций участвующих в реакции хим. соед. Для реакции vAA+vBB:vYY+vzZ, где А и В — реагенты, Y и Z — продукты, vA, vB, 1 d[A] vY и vz — стехиометрия, коэф., скорость v=-(1/vA)(d[A]/dt)= k[А]nА [В]nB, где k — константа скорости реакции, nА и nв- порядки реакции по реагентам А и В соотв.; суммарный порядок реакции п=nА+nв. Для простой реакции, как правило, nА=vA, nB=vB для сложной реакции порядок и стехиометрич. коэф. могут и не совпадать. Для характеристики протекания реакции во времени используют, кроме скорости и константы скорости, такие параметры, как характеристич. время превращения (время, за которое концентрация реагента уменьшается в е раз), период полупревращения (время, в течение которого концентрация реагента уменьшается наполовину) и др. Автокаталитические (см. автокатализ) и цепные реакции часто имеют период индукции — отрезок времени, в течение которого не наблюдается заметного протекания реакции. Зависимость константы скорости от температуры Т обычно выражается в аррениусовской форме: k=Ae−E/RT, где А — предэкспоненц. множитель, Е — энергия активации реакции, R — газовая постоянная (см. Аррениуса уравнение). Для бимолекулярных реакций, согласно столкновений теории, А=z0P, где z0 — фактор частоты столкновений, Р — стерический фактор. Согласно активированного комплекса теории, 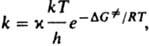 где ( — трансмиссионный коэф., k — постоянная Больцмана, h — постоянная Планка,
где ( — трансмиссионный коэф., k — постоянная Больцмана, h — постоянная Планка, 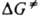 — энергия Гиббса активации реакции (
— энергия Гиббса активации реакции (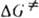 =
=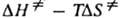 , где
, где 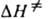 и
и 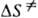 — энтальпия и энтропия активации реакции). Скорость протеканий бимолекулярной реакции в газовой фазе часто характеризуется сечением захвата σ. Методы К. х. Для изучения кинетики хим. реакций широко используются разнообразные методы хим. анализа продуктов и реагентов, физ. методы контроля таких характеристик реагирующей системы, как объем, температура, плотность, спектроскопич., масс-спектрометрич., электрохим., хроматографич. методы. Часто в опытах изменяют концентрации реагентов, температуру, давление, магн. поле, вязкость среды, площадь поверхности реакц. сосуда. В систему, где протекает реакция, вводят как в начале опыта, так и по ходу опыта инициаторы радикальные, ингибиторы, катализаторы, промежут. или конечные продукты. Для изучения превращения отдельных фрагментов молекулы используют реагенты с изотопными метками, оптически активные реагенты, воздействуют на систему лазерным излучением. При изучении цепных и нецепных радикальных реакций используют акцепторы своб. радикалов и вещества-ловушки своб. радикалов (см. спиновых ловушек метод). Реакции активных (быстро превращающихся) частиц изучают спец. кинетич. методами (см. адиабатического сжатия метод, диффузионных пламён метод, конкурирующих реакций метод, молекулярных пучков метод, релаксационные методы, струевые кинетические методы, ударных труб метод). Теоретич. анализ эксперим. данных проводят с использованием методов совр. вычислит. математики. Мат. методы используются для решения т. наз. прямой задачи К. х. расчета кинетич. поведения продуктов и реагентов при заданной схеме реакции и известной константе скорости и обратной задачи К. х. воссоздания схемы реакции и кинетич. параметров по эксперим. данным. Реакции в газе, жидкости, твердом теле. Изучение газофазных реакций имеет важное значение для теоретич. К. х., так как в газе можно наблюдать реакцию в "чистом виде" и исключить (или выявить) роль частиц, не вступающих в реакцию. Большой эксперим. материал накоплен по мономолекулярным реакциям; для них разработана статистич. теория Раиса Рамспергера Касселя-Маркуса, которая позволяет рассчитать константу скорости распада в условиях максвелл-больцмановского равновесия. Много кинетич. данных в виде констант скорости получено для бимолекулярных реакций с участием малоатомных молекул, радикалов и ионов. Реакции рекомбинации и присоединения атомов и радикалов осуществляются при условии стабилизации возбужденной молекулы продукта в результате столкновения с третьей частицей. Теоретич. расчет константы скорости бимолекулярной реакции — сложная задача, которая включает расчет поверхности потенциальной энергии и движения ядер частиц-реагентов по этой поверхности. Для решения этой задачи разработаны неэмпирич. и полуэмпирич. методы. Важное место занимает изучение зависимости скорости или константы скорости газофазных моно- и бимолекулярных реакций от давления, т. к. от частоты столкновений частиц зависит их активация. Реакции, протекающие в жидкой фазе, чрезвычайно разнообразны как по строению реагентов, так и по механизмам превращения (см. реакции в растворах). При диссоциации молекулы на свобод. радикалы и атомы наблюдается клетки эффект. Медленная (в сравнении с газом) диффузия частиц в жидкости приводит к тому, что безактивационные бимолекулярные реакции протекают как диффузионно-контролируемые реакции. Реакции, имеющие значит. энергию активации, протекают, как правило, в кинетич. режиме. Реагенты в растворе часто образуют между собой мол. комплексы и разнообразные ассоциаты. Это отражается на кинетике реакции и часто существенно меняет кинетич. закономерности процесса. Полярный растворитель облегчает ионизацию молекулы, в растворе появляются контактные и разделенные ионные пары. Возникает вероятность параллельного протекания реакции по разным механизмам. Нередко, однако, реакция протекает по мол. механизму как самосогласованный процесс перестройки мол. орбиталей реагирующих частиц (см. Вудворда — Хофмана правила). Окислит.-восстановит. реакции могут происходить в жидкости по механизму квантового туннелирования (см. туннельный эффект). В хим. технологии широко распространены гетерофазные реакции, при которых реагенты находятся в разных фазах, а реакция протекает на границе раздела фаз. Скорость таких реакций зависит от площади поверхности раздела фаз, коэф. диффузии реагентов и продуктов, условий перемешивания, кинетич. параметров реакции. Теоретич. описание кинетики таких реакций связано с решением диффузионной задачи (см. макрокинетика). Хим. реакции в твердой фазе отличаются тем, что продукты образуют новую фазу и протекание реакции осложнено зарождением новой фазы. Реакция протекает на границе раздела фаз. Ее обычно характеризуют степенью превращения x, а скорость реакции — производной dx/dt. Кинетич. кривая имеет S-образный характер. Важную роль в возникновении новой фазы играют дефекты кристаллич. решетки (см. реакции в твердых телах). Среди сложных реакции широко распространены цепные реакции, при которых образующийся в системе активный центр (своб. атом, радикал, ион, ион-радикал) вызывает циклически повторяющуюся цепочку превращений реагентов в продукты. В сложном цепном процессе выделяют стадии зарождения, продолжения, разветвления и обрыва цепи. Различают реакции неразветвленные, разветвленные, с энергетич. разветвлением и вырожденно-разветвленные. По цепному механизму протекает распад мн. молекул, в т. ч. крекинг углеводородов, окисление орг. соед. молекулярным кислородом, радикальная и ионная полимеризации, хлорирование, бромирование, сульфохлорирование и т. п.
— энтальпия и энтропия активации реакции). Скорость протеканий бимолекулярной реакции в газовой фазе часто характеризуется сечением захвата σ. Методы К. х. Для изучения кинетики хим. реакций широко используются разнообразные методы хим. анализа продуктов и реагентов, физ. методы контроля таких характеристик реагирующей системы, как объем, температура, плотность, спектроскопич., масс-спектрометрич., электрохим., хроматографич. методы. Часто в опытах изменяют концентрации реагентов, температуру, давление, магн. поле, вязкость среды, площадь поверхности реакц. сосуда. В систему, где протекает реакция, вводят как в начале опыта, так и по ходу опыта инициаторы радикальные, ингибиторы, катализаторы, промежут. или конечные продукты. Для изучения превращения отдельных фрагментов молекулы используют реагенты с изотопными метками, оптически активные реагенты, воздействуют на систему лазерным излучением. При изучении цепных и нецепных радикальных реакций используют акцепторы своб. радикалов и вещества-ловушки своб. радикалов (см. спиновых ловушек метод). Реакции активных (быстро превращающихся) частиц изучают спец. кинетич. методами (см. адиабатического сжатия метод, диффузионных пламён метод, конкурирующих реакций метод, молекулярных пучков метод, релаксационные методы, струевые кинетические методы, ударных труб метод). Теоретич. анализ эксперим. данных проводят с использованием методов совр. вычислит. математики. Мат. методы используются для решения т. наз. прямой задачи К. х. расчета кинетич. поведения продуктов и реагентов при заданной схеме реакции и известной константе скорости и обратной задачи К. х. воссоздания схемы реакции и кинетич. параметров по эксперим. данным. Реакции в газе, жидкости, твердом теле. Изучение газофазных реакций имеет важное значение для теоретич. К. х., так как в газе можно наблюдать реакцию в "чистом виде" и исключить (или выявить) роль частиц, не вступающих в реакцию. Большой эксперим. материал накоплен по мономолекулярным реакциям; для них разработана статистич. теория Раиса Рамспергера Касселя-Маркуса, которая позволяет рассчитать константу скорости распада в условиях максвелл-больцмановского равновесия. Много кинетич. данных в виде констант скорости получено для бимолекулярных реакций с участием малоатомных молекул, радикалов и ионов. Реакции рекомбинации и присоединения атомов и радикалов осуществляются при условии стабилизации возбужденной молекулы продукта в результате столкновения с третьей частицей. Теоретич. расчет константы скорости бимолекулярной реакции — сложная задача, которая включает расчет поверхности потенциальной энергии и движения ядер частиц-реагентов по этой поверхности. Для решения этой задачи разработаны неэмпирич. и полуэмпирич. методы. Важное место занимает изучение зависимости скорости или константы скорости газофазных моно- и бимолекулярных реакций от давления, т. к. от частоты столкновений частиц зависит их активация. Реакции, протекающие в жидкой фазе, чрезвычайно разнообразны как по строению реагентов, так и по механизмам превращения (см. реакции в растворах). При диссоциации молекулы на свобод. радикалы и атомы наблюдается клетки эффект. Медленная (в сравнении с газом) диффузия частиц в жидкости приводит к тому, что безактивационные бимолекулярные реакции протекают как диффузионно-контролируемые реакции. Реакции, имеющие значит. энергию активации, протекают, как правило, в кинетич. режиме. Реагенты в растворе часто образуют между собой мол. комплексы и разнообразные ассоциаты. Это отражается на кинетике реакции и часто существенно меняет кинетич. закономерности процесса. Полярный растворитель облегчает ионизацию молекулы, в растворе появляются контактные и разделенные ионные пары. Возникает вероятность параллельного протекания реакции по разным механизмам. Нередко, однако, реакция протекает по мол. механизму как самосогласованный процесс перестройки мол. орбиталей реагирующих частиц (см. Вудворда — Хофмана правила). Окислит.-восстановит. реакции могут происходить в жидкости по механизму квантового туннелирования (см. туннельный эффект). В хим. технологии широко распространены гетерофазные реакции, при которых реагенты находятся в разных фазах, а реакция протекает на границе раздела фаз. Скорость таких реакций зависит от площади поверхности раздела фаз, коэф. диффузии реагентов и продуктов, условий перемешивания, кинетич. параметров реакции. Теоретич. описание кинетики таких реакций связано с решением диффузионной задачи (см. макрокинетика). Хим. реакции в твердой фазе отличаются тем, что продукты образуют новую фазу и протекание реакции осложнено зарождением новой фазы. Реакция протекает на границе раздела фаз. Ее обычно характеризуют степенью превращения x, а скорость реакции — производной dx/dt. Кинетич. кривая имеет S-образный характер. Важную роль в возникновении новой фазы играют дефекты кристаллич. решетки (см. реакции в твердых телах). Среди сложных реакции широко распространены цепные реакции, при которых образующийся в системе активный центр (своб. атом, радикал, ион, ион-радикал) вызывает циклически повторяющуюся цепочку превращений реагентов в продукты. В сложном цепном процессе выделяют стадии зарождения, продолжения, разветвления и обрыва цепи. Различают реакции неразветвленные, разветвленные, с энергетич. разветвлением и вырожденно-разветвленные. По цепному механизму протекает распад мн. молекул, в т. ч. крекинг углеводородов, окисление орг. соед. молекулярным кислородом, радикальная и ионная полимеризации, хлорирование, бромирование, сульфохлорирование и т. п.
Исторический очерк. Первые кинетич. исследования с измерением скорости хим. реакции выполнили Л. Вильгельми (гидролиз тростникового сахара, 1850), М. Бертло и Л. Пеан де Сен-Жиль (этерификация, 1862), Ф. Гаркур и В. Эссон (окисление щавелевой кислоты KMnO4, 1866). К. Гульдберг и П. Вааге сформулировали закон действующих масс (1862 1867); С Аррениус (1889) обосновал роль активных молекул в хим реакции и сформулировал закон температурной зависимости константы скорости простых реакций. Я Вант-Гофф получил формулы, описывающие протекание моно-, би- и три-молекулярных реакций и обобщил эксперим. данные в первой монографии по К х (1884). Н. А. Меншуткин в 70-х гг 19 в. выполнил серию исследований по влиянию среды и строения молекул реагентов на скорость терификации и ввел в отечеств. научную лит. термин "химическая кинетика" (1888). В 30-х гг. 20 в. Г. Эйрингом и М. Поляни разработана теория активир. комплекса. Представления о важной роли промежут. продуктов в протекании сложных реакций вошла в К. х. одновременно. с перекисной теорией окисления Баха -Энглера (1897) и теорией сопряженных реакций окисления Лютера — Шилова (1903). Цепные неразветвленные реакции были открыты М. Боденштейном (1913). Х. Бекстрём показал, что ингибиторы тормозят цепные реакции, обрывая цепи (1926). Цепные разветвленные реакции были открыты Н. Н. Семеновым и С. Хиншелвудом (1926–28). Важный вклад в развитие кинетики цепных реакций внесли В. Н. Кондратьев, В. В. Воеводский, А. Б. Налбандян, Н. М. Эмануэль. Для современной К. х. характерно широкое использование разнообразных методов изучения быстропротекающих хим. процессов, автоматизация эксперимента, использование ЭВМ для обработки эксперим. данных. Кинетич. информация собирается, хранится и используется через банки кинетич. констант. Интенсивно развивается динамика элементарного акта как теоретич. направление К. х. и (с применением ЭВМ) новый эксперим. метод. В неравновесной химической кинетике изучаются процессы передачи энергии и активации молекул. Важное значение приобрели лазерные методы для возбуждения молекул и для контроля за протеканием реакции (см. лазерная химия). Возрос интерес к изучению кинетики реакций в экстремальных условиях, напр. при мех. разрушении вещества, низких температурах (см. механохимия, криохимия).
Лит.: Вант-Гофф Я. Г., Очерки по химической динамике, в его кн.. Избранные труды по химии, М., 1984; Семенов Н. Н., Цепные реакции, 2 изд., М., 1986; Мелвин-Хьюз Э. А., Равновесие и кинетика реакций в растворах, М., 1975; Кондратьев В.Н., Никитин Е.Е.. Химические процессы в газах, М., 1981; Эйринг Г., Лин С. Г., Лин С М., Основы химической кинетики, пер. с англ., М., 1983; Эмануэль Н. М., Кнорре Д. Г, Курс химической кинетики, М., 1985; Денисов Е.Т., Кинетика гомогенных химических реакций, М., 1988.
Е. Т. Денисов
Значения в других словарях
- Кинетика химическая — Кинетика химических реакций, учение о химических процессах — о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности... Большая советская энциклопедия
- КИНЕТИКА ХИМИЧЕСКАЯ — КИНЕТИКА ХИМИЧЕСКАЯ — раздел физической химии, учение о скоростях и механизмах химических реакций. Кинетика химическая — научная основа создания новых и совершенствования существующих процессов химической технологии. Большой энциклопедический словарь
