конкурирующих реакций метод
КОНКУРИРУЮЩИХ РЕАКЦИЙ МЕТОД в химической кинетике
основан на том, что одна и та же активная частица (атом, своб. радикал, ион) может одновременно участвовать в неск. реакциях с образованием разл. продуктов. Условия подбираются такими, при которых параллельные реакции протекают с соизмеримыми скоростями. Из соотношения скоростей этих реакций (или концентраций образовавшихся продуктов) вычисляют отношения констант скорости реакций исследуемой частицы с соответствующими реагентами. К. р. м. применяют для изучения гл. обр. радикальных и ионных реакций; он позволяет вычислять абс. значения констант скорости быстрых реакций, оценивать реакционная способность разл. атомных групп в молекуле, в сочетании с методом изотопных индикаторов определять кинетический изотопный эффект. Конкурирующие реакции м. б. разного типа. В частности, это м. б. конкуренция между моно- и бимолекулярной реакциями. Например, при термич. распаде трет-бутилпероксида в присутствии углеводорода RH протекают реакции:
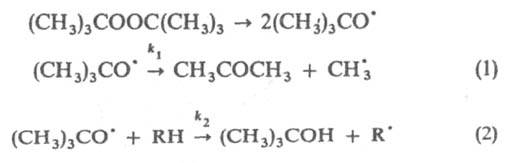
Образующиеся радикалы 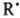 ,
, 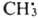 и
и 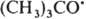 рекомбинируют. Отношение скоростей реакций (2) и (1) v2/v1=k2[RH]/kl. Если в системе избыток RH, то v2/vl=[(CH3)3СОН]/[CH3COCH3] и можно определить k2/k1=[(CH3)3COH]/[CH3COCH3] [RH]. Поскольку известна при температуре Т k1=3,2∙1013ехр[(-69 кДж/моль−1)/RT] с−1 (газовая фаза), метод позволяет определить k2 (R-газовая постоянная). При изучении радикальных реакций часто используют конкуренцию между рекомбинацией радикалов и их взаимод. с молекулами. Например, при изучении реакций CH3 проводят фотолиз паров ацетона в присутствии углеводорода RH, что вызывает протекание реакций:
рекомбинируют. Отношение скоростей реакций (2) и (1) v2/v1=k2[RH]/kl. Если в системе избыток RH, то v2/vl=[(CH3)3СОН]/[CH3COCH3] и можно определить k2/k1=[(CH3)3COH]/[CH3COCH3] [RH]. Поскольку известна при температуре Т k1=3,2∙1013ехр[(-69 кДж/моль−1)/RT] с−1 (газовая фаза), метод позволяет определить k2 (R-газовая постоянная). При изучении радикальных реакций часто используют конкуренцию между рекомбинацией радикалов и их взаимод. с молекулами. Например, при изучении реакций CH3 проводят фотолиз паров ацетона в присутствии углеводорода RH, что вызывает протекание реакций:
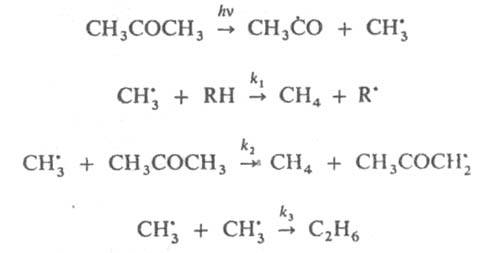
Измеряются скорости образования метана 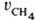 и этана
и этана 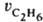 ; отношение
; отношение
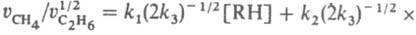
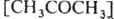 ,
,
что позволяет вычислить k1 и k2 при известной k3=2∙1010 л/моль∙с (газовая фаза, давление выше 10 кПа). Этим методом измерены константы скорости гомолитич. распада для неск. сотен соединений. Если в молекуле имеется неск. реакц. центров, анализ образующихся изомеров позволяет определить относит, реакционная способность каждого из этих центров. Например, при нитровании толуола азотной кислотой образуются о-, м- и n-нитротолуолы:
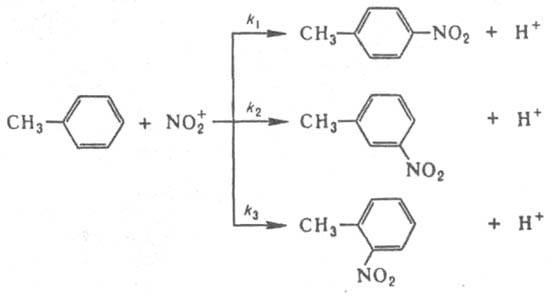
Соотношение между количествами о-, м- и n-нитротолуолов равно 2k3:2k2:k1.
Лит.: Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Денисов Е. Т., Кинетика гомогенных химических реакций, М.. 1978.
Е. Т. Денисов
