реакции в твердых телах
РЕАКЦИИ В ТВЕРДЫХ ТЕЛАХ
реакции, протекающие в потенц. поле решетки, образуемой частицами твердого тела. Реагирующие частицы (хим. подсистема) могут находиться в узлах упорядоченной структуры (кристалл) или неупорядоченной структуры (аморфное твердое тело), а также в междоузельном пространстве. В рамках активированного комплекса теории движение хим. подсистемы вдоль координаты реакции по поверхности своб. энергии сопровождается изменением состояния решетки (переориентацией частиц), аналогичным реорганизации среды, т. е. изменению положения и ориентации молекул растворителя при реакциях в растворах. Особенностью Р. в т. т. является неравновесный характер взаимод. хим. подсистемы со средой: характеристич. время тх, связанное с движением хим. подсистемы, намного меньше характеристич. времени тq, определяющего переориентацию частиц в решетке, вследствие чего Р. в т. т. сопровождаются появлением в среде мех. деформаций. Константа скорости ks P. в т. т. определяется выражением:
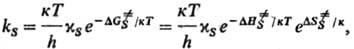
где 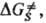
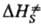 и ΔS∙ — соотв. изменения энергии Гиббса, энтальпии и энтропии хим. подсистемы при переходе к переходному состоянию (ПС), или своб. энергия активации, энтальпия активации и энтропия активации реакции, xs ! 1 — трансмиссионный множитель, расчет которого выходит за рамки теории активир. комплекса, к и h-постоянные Больц-мана и Планка соотв., Т — абс. температура. В наиб. простом случае реакции в бездефектном плотноупакованном кристалле, где реагирующие частицы расположены в узлах решетки, как правило, осн. вклад в
и ΔS∙ — соотв. изменения энергии Гиббса, энтальпии и энтропии хим. подсистемы при переходе к переходному состоянию (ПС), или своб. энергия активации, энтальпия активации и энтропия активации реакции, xs ! 1 — трансмиссионный множитель, расчет которого выходит за рамки теории активир. комплекса, к и h-постоянные Больц-мана и Планка соотв., Т — абс. температура. В наиб. простом случае реакции в бездефектном плотноупакованном кристалле, где реагирующие частицы расположены в узлах решетки, как правило, осн. вклад в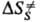 дает изменение колебат. энтропии кристалла при образовании ПС, которое настолько незначительно, что в первом приближении величиной
дает изменение колебат. энтропии кристалла при образовании ПС, которое настолько незначительно, что в первом приближении величиной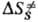 можно пренебречь. Величина
можно пренебречь. Величина 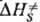 включает в себя изменение энтальпии хим. подсистемы
включает в себя изменение энтальпии хим. подсистемы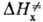 , рассматриваемой изолированно, и изменение энтальпии
, рассматриваемой изолированно, и изменение энтальпии , обусловленное мех, деформациями решетки:
, обусловленное мех, деформациями решетки:
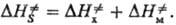
В зависимости от взаимной ориентации реагирующих частиц и остальных частиц решетки возможны разл. конфигурации ПС (разл. пути реакции) и соотв. разная структура образующегося продукта. В плотноупакованном бездефектном кристалле решетка, окружающая хим. подсистему, может считаться абсолютно хлесткой и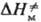 представляет собой изменение энтальпии лишь вследствие деформации связей реагирующих частиц с фиксир. решеткой. Эта величина определяется в осн. силами отталкивания, которые экспоненциально увеличиваются по мере усиления деформации связей. Поэтому, если ПС по своей конфигурации сильно отличается от исходного состояния хим. подсистемы, на пути реакции возникает чрезвычайно высокий барьер. Оценки на основе метода атом-атомных потенциалов (см. молекулярная механика) показывают, что Р. в т. т. протекают лишь в тех случаях, если при переходе к ПС межатомные расстояния "спрессовываются" не более чем на 30–40%. В большинстве кристаллов возможный путь реакции и соотв. структура продукта однозначно определяются условием минимума
представляет собой изменение энтальпии лишь вследствие деформации связей реагирующих частиц с фиксир. решеткой. Эта величина определяется в осн. силами отталкивания, которые экспоненциально увеличиваются по мере усиления деформации связей. Поэтому, если ПС по своей конфигурации сильно отличается от исходного состояния хим. подсистемы, на пути реакции возникает чрезвычайно высокий барьер. Оценки на основе метода атом-атомных потенциалов (см. молекулярная механика) показывают, что Р. в т. т. протекают лишь в тех случаях, если при переходе к ПС межатомные расстояния "спрессовываются" не более чем на 30–40%. В большинстве кристаллов возможный путь реакции и соотв. структура продукта однозначно определяются условием минимума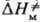 . Такие Р. в т. т. относятся к топонимическим реакциям. Др. тип Р. в т. т. характерен для пластичных кристаллов, образованных квазисферич. или квазицилинд-рич. молекулами, в которых барьеры переориентации частиц решетки при образовании ПС невысоки и поэтому возможны разные пути реакции и соотв. различные по структуре продукты.
. Такие Р. в т. т. относятся к топонимическим реакциям. Др. тип Р. в т. т. характерен для пластичных кристаллов, образованных квазисферич. или квазицилинд-рич. молекулами, в которых барьеры переориентации частиц решетки при образовании ПС невысоки и поэтому возможны разные пути реакции и соотв. различные по структуре продукты.
Влияние кристаллич. структуры на структуру продукта м. б. проиллюстрировано на примере термич. димеризации изоцианатных групп, единств. продукт реакции в кристалле-напряженные 4-членные азетидиновые циклы. В растворе такие циклы не образуются, а возникают более стабильные 6-член-ные кольца:
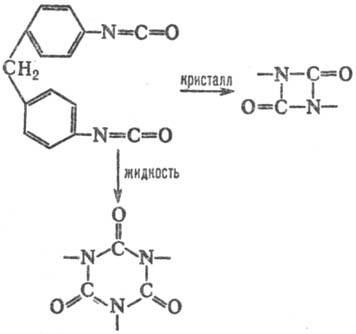
Формирование таких колец при димеризации в кристаллич. фазе требует значит. переориентации частиц решетки и поэтому полностью заторможено. Частичное превращение хим. энергии в энергию напряжения 4-членных азетиди-новых циклов обусловлено отсутствием релаксации среды. В области дефектов кристаллич. структуры, где плотная упаковка нарушается и. появляется некоторый своб. объем, становится возможным изменение ориентации частиц и нарушается корреляция между конфигурациями исходного состояния хим. подсистемы, ПС и продукта. Если ПС образуется в своб. объеме дефекта, то, в отличие от реакций в бездефектном кристалле, 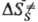 > 0, поскольку при образовании ПС появляются дополнит. степени свободы. Во мн. случаях молярный объем продукта меньше молярного объема реагирующей подсистемы, что приводит к изменению структуры продукта. Например, при твердофазной полимеризации структура образующихся в начале процесса полимерных цепей определяется лишь структурой решетки, но по мере увеличения конверсии мономера и "разрыхления" кристалла структура цепей постепенно приближается к той, которая характерна для жидкофазной полимеризации.
> 0, поскольку при образовании ПС появляются дополнит. степени свободы. Во мн. случаях молярный объем продукта меньше молярного объема реагирующей подсистемы, что приводит к изменению структуры продукта. Например, при твердофазной полимеризации структура образующихся в начале процесса полимерных цепей определяется лишь структурой решетки, но по мере увеличения конверсии мономера и "разрыхления" кристалла структура цепей постепенно приближается к той, которая характерна для жидкофазной полимеризации.
Изменение константы скорости реакции при переходе от жидкой среды к равновесному кристаллу определяется отношением:
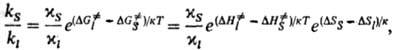
где индексами S и / обозначены соответствующие величины при реакции в кристалле и в клетке, образованной молекулами растворителя (см. клетки эффект). В первом приближении для маловязких сред можно считать 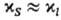 . Поскольку кристалл, в отличие от жидкой среды, не подстраивается к хим. подсистеме в процессе образования ПС, Р. в т. т. связаны с преодолением более высокого потенц. барьера, чем аналогичные реакции в жидкости. Например, рекомбинация радикальных пар в растворе является практически безактива-ционной, а в кристалле требует значит. энергии активации. В случае мономолекулярных реакций, константы скорости которых определяются в осн. энергетич. факторами, а не энтропийными, можно ожидать замедления реакций в кристалле. Для бимолекулярных реакций следует учитывать и энтропийный фактор; в первом приближении
. Поскольку кристалл, в отличие от жидкой среды, не подстраивается к хим. подсистеме в процессе образования ПС, Р. в т. т. связаны с преодолением более высокого потенц. барьера, чем аналогичные реакции в жидкости. Например, рекомбинация радикальных пар в растворе является практически безактива-ционной, а в кристалле требует значит. энергии активации. В случае мономолекулярных реакций, константы скорости которых определяются в осн. энергетич. факторами, а не энтропийными, можно ожидать замедления реакций в кристалле. Для бимолекулярных реакций следует учитывать и энтропийный фактор; в первом приближении 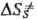 —
—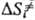 ! — ΔSпл, где ΔSпл-энтальпия плавления кристалла. Энтропийная составляющая изменения энергии Гиббса системы, в отличие от энергетической, приводит к увеличению отношения констант скорости ks/kl.
! — ΔSпл, где ΔSпл-энтальпия плавления кристалла. Энтропийная составляющая изменения энергии Гиббса системы, в отличие от энергетической, приводит к увеличению отношения констант скорости ks/kl.
Влияние на скорости Р. в т. т. величины мех. деформации при образовании ПС м. б. понято на примере термич. изомеризации n-диметилбензолсульфоната (ДМБС) в результате межмол. переноса метильной группы:
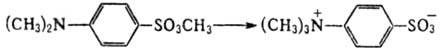
В решетке кристалла реагирующие атомные группы (CH3)2N и SO3CH3 тесно контактируют друг с другом; энергия мех. деформаций, как подтверждают расчеты, мала. Поэтому осн. вклад в константу скорости дает энтропийный член, что обусловливает значит. ускорение реакции и в кристалле в сравнении с жидкой фазой. Если же при Р. в т. т. мех. деформации велики, становится определяющим энергетич. член в выражении для константы скорости kS и бимолекулярная реакция замедляется. Однако решетка может рассматриваться как равновесная лишь в самом начале реакции. По мере развития мех. деформаций меняются условия для реакции, что сказывается на ее кинетике. Это особенно важно для цепных твердофазных реакций, поскольку последоват. акты роста цепи происходят в соседних ячейках кристалла и связаны друг с другом не только химически, но и механически. Например, полимеризация диацетиленов эффективно протекает в кристаллич. состоянии, а в жидкой фазе практически не идет. В соответствии со структурой мономерного кристалла первичная димеризация молекул с образованием бирадикала в равновесной кристаллич. ячейке в условиях заторможенной релаксации решетки приводит к превращению части хим. энергии в энергию мех. деформаций. Это, в свою очередь, приводит к продвижению радикальных центров по координате реакции в следующих актах роста цепи. Радикальный центр оказывается в деформированной sp2-конфигурации, которая, как показывают квантовохим. расчеты, более реакционноспособна, чем равновесная линейная sp-конфигурация. Рост цепи сопровождается движением фронта локальной мех. деформации, сильно понижающей энергию активации роста цепи.
Константы скорости Р. в т. т. однозначно м. б. определены только применительно к идеальному кристаллу. В реальном кристаллич. веществе со множеством дефектов (вакансии, дислокации, границы зерен в поликристаллах и т. д.) Р. в т.т. характеризуются многими константами скорости ki которые определяются локальным окружением реагирующих частиц в i-й области кристалла. Эффективная константа скорости kэфф = Sziki, где zi-объемная доля i-й области. Вещество в более реакционноспособных областях расходуется быстрее, чем в остальных, поэтому kэфф меняется в ходе реакции. Такая кинетика наз. полихронной.
Аморфные (стеклообразные) твердые тела имеют неравновесную структуру, возникающую при быстром охлаждении жидкости или быстрой конденсации паров. В таких телах существуют "замороженные" участки своб. объема, где условия для реакции приближаются к условиям в жидкости, т. е. возможна реорганизация среды. С др. стороны, в аморфных твердых телах существуют кластеры из плотно-упакованных молекул, близкие по структуре к кристаллич. фазе. Реакции в кластерах по своей кинетике и механизму приближаются к Р. в т. т. и приводят к образованию метастабильных упорядоченных структур продуктов.
Р. в т. т. широко распространены в природе и используются в хим. технологии. Важнейшие из них: изменение состава горных пород под действием воды, кислорода воздуха, организмов и т. п. (хим. выветривание); образование и превращение минералов; реакции, протекающие при обжиге, получении цементов; получение катализаторов; деструкция и окисление полимерных материалов; окисление металлов и сплавов; синтез тугоплавких и термостойких материалов; горение и взрывы твердых ВВ. В совр. микроэлектронике на Р. в т. т. основана, по сути дела, вся технология изготовления резистов. Важнейшее направление — модификация полимерных материалов и создание на этой основе новых веществ со свойствами металлов и полупроводников (см. химия твёрдого тела).
Лит.: Китайгородский А. И., Молекулярные кристаллы, М., 1971; Третьяков Ю. Д., Твердофазные реакции, М., 1978; Браун М., Долли-мор Д., Галвей Л., Реакции твердых тел, пер. с англ., М., 1983; Воldуrev V., Bulens M., Delmon В., The control of the reactivity of solids, Amst., 1979; Gavezzotti A., Simonetta M., "Chem. Rev.", 1982, v. 82, № 1, p. 1–13.
Г. Н. Герасимов
