1,3-бутадиен
1,3-БУТАДИЕН (дивинил) СН^СН —CH=CH2
мол. м. 54,09; бесцветный газ с характерным неприятным запахом; т. пл. −108,9 °C, т. кип. −4,41 °C; плотн. жидкости 0,6211 г/см3 (20 °C); nD25 1,4293; η (мПа∙с) жидкости: 0,29 ( −20 °C), 0,25 (0 °C), 0,20 (40 °C); γ 13,9 мН/м (20 °C); pкрит 4,32 МПа, tкрит 152,0 °C, dкрит 0,245 г/см3; давление пара (МПа): 0,12 (0 °C), 0,23 (20 °C), 0,56 (50 °C), 1,70 (100 °C); Cр [кДж/(кг∙К)] жидкости 2,23 ( −8,16 °C), газа 1,37 (0СС), 1,47 (25 °C); 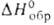 −110,2 кДж/моль,
−110,2 кДж/моль, 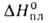 147,7 кДж/кг,
147,7 кДж/кг, 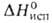 (кДж/кг): 418 ( −4,41 °C), 389 (25 °C), ΔH0сгор −2545 кДж/моль, ΔHгидрирования −236 кДж/моль, ΔHполим −72,85 кДж/моль (5-50С); S0298 278,7 Дж/(моль∙К); хорошо раств. в бензоле, эфире, хлороформе, CCl4, плохо — в метаноле и этаноле. Растворимость Б. в воде при нормальных условиях 0,09% (по массе), воды в жидком Б. 0,07% (25 °C). Образует азеотропные смеси с бутаном (75,4% Б.; т. кип. −5,5 °C), 2-бутеном (77% Б.; т. кип. −5,53 °C) и др.
(кДж/кг): 418 ( −4,41 °C), 389 (25 °C), ΔH0сгор −2545 кДж/моль, ΔHгидрирования −236 кДж/моль, ΔHполим −72,85 кДж/моль (5-50С); S0298 278,7 Дж/(моль∙К); хорошо раств. в бензоле, эфире, хлороформе, CCl4, плохо — в метаноле и этаноле. Растворимость Б. в воде при нормальных условиях 0,09% (по массе), воды в жидком Б. 0,07% (25 °C). Образует азеотропные смеси с бутаном (75,4% Б.; т. кип. −5,5 °C), 2-бутеном (77% Б.; т. кип. −5,53 °C) и др.
1,3-Бутадиен (Б.) существует в виде s-цис- и s-транс-конформеров:
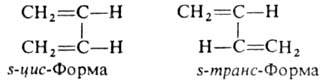
s-транс-Форма более устойчива; ее содержание при комнатной температуре 93–97%.
Б. — типичный диеновый углеводород с сопряженными двойными связями; характеризуется высокой реакционной способностью. Легко полимеризуется и сополимеризуется со стиролом, нитрилами или эфирами акриловой и метакриловой кислот, винил- и метилвинилпиридинами, винили винилиденхлоридами, изобутиленом, изопреном и др. По двойным связям к Б присоединяются H2, галогены, галогеноводороды и др. Вещества с активированной двойной связью, напр. малеиновый ангидрид, акролеин, стирол, акрилонитрил, присоединяются к Б. в положения 1,4 с образованием производных циклогексена (см. диеновый синтез). Б. самопроизвольно димеризуется с образованием 4-винил-1-циклогексена (реакция ускоряется с повышением температуры); в присутствии некоторых катализаторов, напр. (C2H5)2А1С1 + TlCl4, образует циклич. ди- и тримеры, напр. 1,5,9-циклододекатриен; легко присоединяет при 100 °C SO2, давая циклич. сульфолен, из которого Б. может быть регенерирован при ~ 125 °C. Эта реакция м. б. использована для выделения чистого Б. из смеси с близкокипящими олефинами и парафинами. В присут. O2 воздуха Б. образует пероксиды, инициирующие его самопроизвольную полимеризацию с образованием полимеров сложного состава и строения.
В промышленности Б. получают в осн. каталитич. дегидрированием н-бутана или н-бутенов, содержащихся в газах нефтепереработки и попутных газах, или выделяют из фракции C4 пиролиза нефтепродуктов (при производстве этилена).
В двухстадийном процессе бутан сначала дегидрируют в бутены в "кипящем" слое алюмохромового кат. при 560–600 °C; выход 28–30% (суммарный выход бутенов и Б. 30–34%). Бутены выделяют экстрактивной ректификацией с водным ацетоном или ДМФА. На второй стадии их разбавляют перегретым паром и дегидрируют в Б. на хромкальцийникельфосфатном кат. в адиабатич. реакторе при 600–660 °C; выход 33–40%. Б. выделяют экстрактивной ректификацией с безводным ацетонитрилом, ДМФА или др., хемосорбцией водно-аммиачным раствором CH3COOСи. В одностадийном процессе бутан дегидрируют в Б. на неподвижном алюмохромовом кат. в вакууме (0,016–0,020 МПа) при 550–650 °C и времени контактирования 5–10 мин; выход 11–14%.
Окислительное дегидрирование бутенов (или бутана) характеризуется большим выходом Б. и меньшими энергетич. затратами. Бутены в смеси с водяным паром и горячим воздухом дегидрируют при 400–500 °C в реакторах с неподвижным слоем катализатора на основе оксидов Fe или др.; выход 60–75%.
Наиб. экономично выделение Б. из фракции C4 пиролиза жидких и газообразных нефтепродуктов, получаемой при производстве этилена. Из фракции C4, содержащей 20–60% Б. (в зависимости от состава сырья и условий процесса), его выделяют экстрактивной ректификацией; выход на исходное сырье не более 3–5%, по отношению к этилену — 12–18%. За рубежом этим способом производится более 80% Б.
В лаборатории Б. может быть получен, напр., пиролизом циклогексена (пары последнего пропускают через трубку над сплавом никеля, железа и хрома, нагретым до температуры красного каления; выход 65–75%), а также дегидратацией 1,3-бутиленгликоля. Хим. методы идентификации Б. основаны на определении продуктов его взаимод. с бромом (тетрабромид, т. пл. 118–119 °C), малеиновым ангидридом (ангидрид тетрагидрофталевой кислоты, т. пл. 103–104 °C) или др.
Б. — один из осн. мономеров для производства СК (см. бутадиеновые каучуки, бутадиен-стирольные каучуки, бутадиен-нитрильные каучуки); используется также для получения пластмасс (см., напр., АБС-пластик), адиподинитрила, хлоропрена, бутиленгликоля, цикледодекатриена, 1,4-гексадиена и др.
Б. — горюч, взрывоопасен. КПВ 1,1–12,5%; т. всп. −85 °C, т. самовоспл. 415 °C. В малых концентрациях Б. раздражает слизистые оболочки глаз и дыхательных путей; ПДК 0,1 мг/л.
Б. хранят в присутствии ингибиторов (0,005–0,03%) п-трет-бутилпирокатехина, n-гидроксидифениламина, древесносмольного антиоксиданта или др. Перед использованием Б. ингибиторы удаляют отмывкой водным раствором NaOH и ректификацией.
Мировое производство Б. составляет ок. 5 млн. т.
Впервые Б. получен франц. химиком Ж. Б. Каванту в 1862 пиролизом сивушного масла. Первое пром. производство Б. в СССР было организовано по методу С. В. Лебедева из этилового спирта.
Лит.: Энциклопедия полимеров, т. 1, М., 1972, с. 299–302; Справочник нефте-химика, под ред. С. К. Огороднмкова, т. 1–2, Л., 1978; Химия и технология мономеров для синтетич. каучуков, Л„ 1981; Kirk-Othmer encyclopedia, 3 ed., v. 4, N. Y.-[a.o.], 1978, p 313–37.
Ф. Е. Куперман
