фосфонаты
ФОСФОНАТЫ
эфиры фосфоновых кислот общей формулы 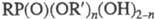 , где R, R' — орг. радикал, n — 1, 2 (иногда к Ф. необоснованно относят любые производные фосфоновых, а также тио- и селенофосфоновых кислот). Ф. называют также соли фосфоновых кислот.
, где R, R' — орг. радикал, n — 1, 2 (иногда к Ф. необоснованно относят любые производные фосфоновых, а также тио- и селенофосфоновых кислот). Ф. называют также соли фосфоновых кислот.
Ф. подразделяют на кислые, или первичные (n=1), и полные, или вторичные (п = 2). Назв. Ф. включает назв. орг. радикалов (радикала) в алкоксильной группе (приводятся вначале) и назв. радикала у атома P, которые являются префиксами к слову фосфонат; иногда Ф. наз. как эфиры органил-фосфоновых кислот [напр., PhP(O)(OH)OC2H5 — этилфенилфосфонат, или этиловый эфир фенил фос фоновой кислоты].
Ф. встречаются в природе, напр. эфиры 2-аминоэтил- и 2-метиламиноэтилфосфоновых кислот обнаружены в некоторых морских организмах (см. фосфолипиды).
Ф. с низшими алкильными, алкенильными и арильными радикалами у атомов P и О — жидкости, перегоняющиеся в вакууме без разложения, остальные — кристаллич. вещества или масла. Ф., как правило, раств. в органических растворителях, низшие — также в воде. Первичные Ф. — кислоты средней силы [напр., для n-ClC6H4P(O)(OC4H9)OH рKа 1,7], образуют соли с аминами. Соед. с низшими алкоксильными группами обладают выраженной алкилирующей способностью.
Конфигурация молекул Ф. — тетраэдрическая; 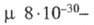 1,57∙10−29 Кл∙м. В спектрах ЯМР 31P хим. сдвиги (в м. д.) 1–53. Полоса поглощения связи P = O в ИК спектрах находится в области 1200–1280 см −1.
1,57∙10−29 Кл∙м. В спектрах ЯМР 31P хим. сдвиги (в м. д.) 1–53. Полоса поглощения связи P = O в ИК спектрах находится в области 1200–1280 см −1.
Диариловые эфиры обычно устойчивы до 300 °C, диалкиловые выше 150 °C постепенно разлагаются, образуя кислый Ф. и олефин. При нагр. кислые Ф. диспропорционируют и дают конденсир. полифосфаты, ди- -галогеналкиловые эфиры подвергаются гомополиконденсации;
-галогеналкиловые эфиры подвергаются гомополиконденсации;  гидроксиалкил-фосфонаты в зависимости от условий проведения реакции и строения соед. претерпевают разл. превращения:
гидроксиалкил-фосфонаты в зависимости от условий проведения реакции и строения соед. претерпевают разл. превращения:
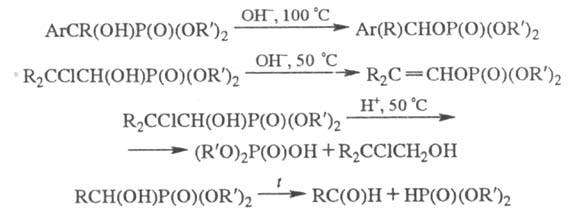
Большинство Ф. устойчиво к гидролизу. В водных растворах щелочей полный гидролиз диалкилфосфонатов достигается при температурах ок. 130 °C под давлением, в присутствии кислот для этого требуется многочасовое кипячение. Сравнительно легко гидролизуются Ф., содержащие в β-положении алкоксильного радикала Hal, R'O и R'2N, а также некоторые виниловые эфиры. При щелочном гидролизе эфиров пергалоген- и 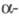 гидрокси-алкилфосфоновых кислот наблюдается разрыв связи P-C.
гидрокси-алкилфосфоновых кислот наблюдается разрыв связи P-C.
Благодаря электронодонорным свойствам полные Ф. образуют устойчивые адцукты с BX3 (X = Hal, OR') и AlR'3. Кислые Ф. [напр., (2-этилгексил)метилфосфонат] способны связывать в прочные комплексы ионы тяжелых металлов (U, Th, Pu и др.).
При действии PCl5 полные и кислые Ф. превращаются в хлорангидриды RP(O)(OR')С1, при действии RC(O)F полные Ф. — во фторангидриды. При нагр. хлорангидридов RP(O)(OR')Cl с кислыми Ф. образуются пирофосфонаты RP(O)(OR')OP(O)R(OR'). При смешении полного Ф. и RP(O)F2 при 100–150 °C спустя 20–30 ч устанавливается равновесие:
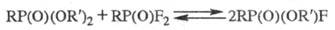
Ф. с активной метиленовой группой у атома P. используют для алкенилирования карбонильных соед. (см. Хорнера реакция). Диэфиры 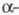 алкенилфос фоновых кислот присоединяют по кратной связи ROH, RSH, HNR2 и HP(O)(OR)2.
алкенилфос фоновых кислот присоединяют по кратной связи ROH, RSH, HNR2 и HP(O)(OR)2.
Ф. получают взаимод. RP(O)Cl2 со спиртами, фенолами или с их Na- или К-производными (в зависимости от условий получают полные или кислые Ф.); перегруппировкой третичных фосфитов под действием RHal (см. Арбузова реакция); реакцией алкилирования вторичных фосфитов (см. Михаэлиса — Беккера реакция); присоединением вторичных фосфитов к соед. с активированными двойными или тройными связями (см., напр., Кабачника — Филдса реакция); окислением (с помощью H2O2, N2O4 и др.) эфиров фосфонистых кислот 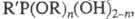 где n = 1–2; этерификацией фосфоновых кислот окисями олефинов, эфирами ортокарбоновых кислот, третичными фосфитами, диазоалканами и спиртами (в присут. карбо-диимидов или др. конденсирующих агентов); взаимод. алкил-галогенидов с PHal3 и AlCl3 (см. Клея — Киннера — Перрена реакция).
где n = 1–2; этерификацией фосфоновых кислот окисями олефинов, эфирами ортокарбоновых кислот, третичными фосфитами, диазоалканами и спиртами (в присут. карбо-диимидов или др. конденсирующих агентов); взаимод. алкил-галогенидов с PHal3 и AlCl3 (см. Клея — Киннера — Перрена реакция).
Многие Ф. — пестициды [напр., хлорофос Cl3CCH(OH)P(O)(OCH3)2], экстрагенты (напр., кислые 2-этилгексиловые эфиры алкилфосфоновых кислот), лек. средства [напр., армин — этил(n-нитрофенил)этилфосфонат], ПАВ (кислые фосфонаты и их соли; см. алканфосфонаты).
Лит. см. при ст. фосфоновые кислоты.
Г. И. Дрозд
