фосфониевые соединения
ФОСФОНИЕВЫЕ СОЕДИНЕНИЯ
содержат в молекуле положительно заряженный атом P, связанный ковалентно с орг. остатками и(или) водородом (т. наз. ион фосфония). Ф. с. имеют общую формулу 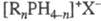 , где R = H, Alk, Ar, алкенил, C(O)R, COOR; X — анион (напр., Hal, OH, NO3, BF4); n = 0–4.
, где R = H, Alk, Ar, алкенил, C(O)R, COOR; X — анион (напр., Hal, OH, NO3, BF4); n = 0–4.
Простейшие представители Ф. с. — соли фосфония 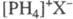 T. к. PH3 представляет собой слабое основание, он образует соли только с сильными кислотами (напр., HClO4, HCl). Сухие соли при нагр. диссоциируют на PH3 и HX. Перхлораты фосфония при нагр. разлагаются со взрывом.
T. к. PH3 представляет собой слабое основание, он образует соли только с сильными кислотами (напр., HClO4, HCl). Сухие соли при нагр. диссоциируют на PH3 и HX. Перхлораты фосфония при нагр. разлагаются со взрывом.
В водной среде или полярных органических растворителях Ф. с. обмениваются анионами с гидроксидами и алкоголятами металлов, кислотами (напр., HNO3, H2SO4) и их солями. Ф. с. образуют устойчивые комплексы с солями Pt, Au, Hg, Cd, а некоторые и с нитратами РЗЭ, CHI3 и галогенами.
Орг. Ф.с. подразделяют на первичные (n= 1), вторичные (п = 2) и т. д. Известны также внутр. четвертичные фосфони-евые соли (фосфобетаины) типа R3P+ZCOO− , где Z = CH2CH2 и др.
Большинство орг. Ф. с. — кристаллич. соед., гидроксиды (X = OH)- вязкие жидкости. Ф. с. раств. в полярных органических растворителях и воде. Растворы гидроксидов в воде — сильные основания; pH растворов других Ф. с. близки к 7.
Конфигурация фосфорсодержащего катиона — тетраэдрическая. Ф. с. с 4 разл. заместителями у атома P могут быть разделены на оптич. изомеры.
Большинство Ф. с. с n = 0–2 при комнатной температуре неустойчиво; в растворах существует равновесие:

Наиб. устойчивы четвертичные Ф. с., многие из которых разлагаются лишь при температурах 250–300 °C. Для галогенидов четвертичных Ф. с. осн. направление разложения — отщепление RHal с образованием фосфинов; для четвертичных Ф. с. с кислородсодержащим анионом (НО− , HSO−4 и др.) характерно образование третичных фосфиноксидов с отщеплением одного из орг. радикалов в виде углеводорода (о разложении гидроксидов см. Гофмана реакции).
Щелочное разложение Ф. с. с n = 0–3 приводит к соответствующим фосфинам или фосфиноксидам. В присут. эквивалентного количества щелочи все Ф. с., содержащие группировки 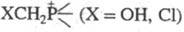 , разлагаются до фосфинов и формальдегида; с избытком щелочи многие гидроксиметильные четвертичные Ф. с. образуют фосфиноксиды.
, разлагаются до фосфинов и формальдегида; с избытком щелочи многие гидроксиметильные четвертичные Ф. с. образуют фосфиноксиды.
При действии литийорг. соед. на четвертичные Ф. с. типа 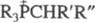 ,а также при обработке основаниями Ф. с.
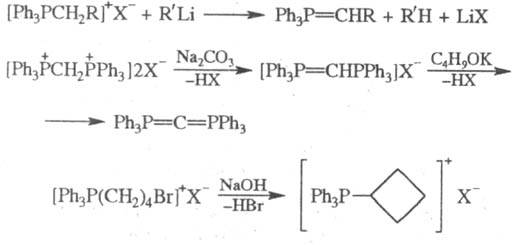
,а также при обработке основаниями Ф. с. 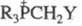 (Y — электроноакцепторная группа) образуются алкилиденфосфораны; в этих же условиях галогениды 4-бромбутилфосфония дают циклобугильные Ф. с., напр.:
(Y — электроноакцепторная группа) образуются алкилиденфосфораны; в этих же условиях галогениды 4-бромбутилфосфония дают циклобугильные Ф. с., напр.:
 -Элиминирование (обычное для солей аммония) наблюдается для Ф. с. в тех случаях, когда карбкатион, образующийся в результате атаки гидроксилом или алкоксилом, стабилизируется благодаря сопряженным связям, напр.:
-Элиминирование (обычное для солей аммония) наблюдается для Ф. с. в тех случаях, когда карбкатион, образующийся в результате атаки гидроксилом или алкоксилом, стабилизируется благодаря сопряженным связям, напр.:
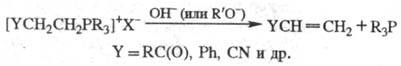
При действии Na, К, LiAlH4 Ф. с. восстанавливаются до фосфинов, напр.:
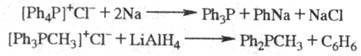
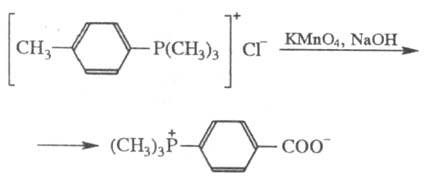
Известно большое число реакций с участием орг. заместителей при атоме P и входящих в их состав функц. групп. Так, гидроксиалкильные группы в Ф. с. при действии SOCl2 или PCl5 превращаются в хлоралкильные, а при обработке ангидридами карбоновых кислот — в сложноэфирные. Окисление некоторых Ф. с. с ароматич. радикалами ведет к фосфобетаинам, напр.:
Общий метод получения Ф. с. типа 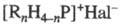 — взаимод. фосфинов с RHal (Hal = Cl, Br, I). Низшие алкилиодиды и третичные фосфины реагируют при обычных условиях; при вовлечении в реакцию RHal с объемными радикалами процесс ведут в полярных растворителях при нагревании; ArHal вступают в реакцию в присутствии катализаторов — галогенидов Al, Fe, Cu, Ni, Со или Zn. Образующиеся галогениды фосфония легко м. б. превращены в гидроксиды обработкой влажной Ag2O, а в Ф. с. с др. анионами — путем ионного обмена.
— взаимод. фосфинов с RHal (Hal = Cl, Br, I). Низшие алкилиодиды и третичные фосфины реагируют при обычных условиях; при вовлечении в реакцию RHal с объемными радикалами процесс ведут в полярных растворителях при нагревании; ArHal вступают в реакцию в присутствии катализаторов — галогенидов Al, Fe, Cu, Ni, Со или Zn. Образующиеся галогениды фосфония легко м. б. превращены в гидроксиды обработкой влажной Ag2O, а в Ф. с. с др. анионами — путем ионного обмена.
Четвертичные Ф. с, можно также получать алкилированием с помощью RHal алкилгалогенфосфинов (в присут. белого P), алкилиденфосфоранов, красного P, P2I4, фосфидов Hg и щелочных металлов.
Ф. легко получаются при взаимодействии фосфинов с соед., образующими в растворах карбкатионы, напр.:

Третичные фосфины м. б. проалкилированы также альдегидами или эпоксидами (в присут. кислот), a PH4I, красный P и фосфиды щелочных металлов — с помощью спиртов и простых эфиров, напр.:
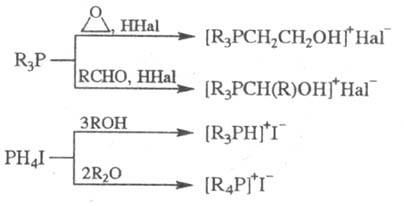
Ф. с. получают также взаимод. RMgHal с галогенидами 5-координац. P и действием HHal на пентакарбофосфораны. Фосфобетаины синтезируют действием NaOH или Ag2O/H2O на Ф. с. типа 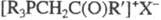 или взаимод. третичных фосфинов с сультонами, CS2, RNCS, RCH = CHCOOH и др. соед., содержащими активир. кратные связи.
или взаимод. третичных фосфинов с сультонами, CS2, RNCS, RCH = CHCOOH и др. соед., содержащими активир. кратные связи.
Ф. с. — инсектициды и гербициды [напр., трибутил(2,4-ди-хлорбензил)фосфонийхлорид, или "фосфон Д", — гербицид и дефолиант], средства борьбы с молью [действующее начало — 3,4-дихлороензил(трифенил)фосфонийхлорид], антипи-рены для текстиля и бумаги, бактерицидные пропитки [осн. компонент — тетра(гидроксиметил)фосфонийхлорид], эмульгаторы, реактивы в цветной фотографии, ингибиторы коррозии, реагенты в орг. синтезе. Среди Ф. с. известны соед. с бактерицидной и ретардантной (тормозят рост растений) активностью. Некоторые полифосфониевые соед. — ганглиобло-каторы.
Лит.: Пурдела Д., Вылчану Р., Химия органических соединений фосфора, пер. с рум., М., 1972, с. 217–64; Beck P., в кн.: Organic phosphorus compounds, eds. G. Kosolapoff, L. Maier, v. 2, N. Y., 1972, p. 189.
С. И. Дрозд
