пиридин
ПИРИДИН
мол. м. 79,1; бесцветная жидкость со специфич. запахом; т. пл. −42,7 °C, т. кип. 115,4 °C/760 мм рт. ст., 13,2 °C/10 мм рт. ст.; 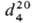 0,9819:
0,9819: 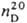 1,5095; μ 7,30∙10−30 Кл∙м; γ 3,7∙10−2 Н/м (25 °C); η 0,885 мПа∙с (25 °C); Cp 135,62 кДж/моль∙K) (17 °C),
1,5095; μ 7,30∙10−30 Кл∙м; γ 3,7∙10−2 Н/м (25 °C); η 0,885 мПа∙с (25 °C); Cp 135,62 кДж/моль∙K) (17 °C), 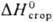 −2783 кДж/моль. Смешивается во всех отношениях с водой и большинством орг. растворителей; с водой образует азеотропную смесь (т. кип. 94 °C, 58% по массе П.).
−2783 кДж/моль. Смешивается во всех отношениях с водой и большинством орг. растворителей; с водой образует азеотропную смесь (т. кип. 94 °C, 58% по массе П.).
П. — основание (рKа 5,20). С неорг. кислотами образует устойчивые соли, с алкилгалогенидами -пиридиния соли, с галогенидами металлов, SO2, SO3, Br2, H2O-комплексные соединения. Характерные производные: (C5H5N∙HCl)2∙PtCl2 (т. пл. 262–264 °C, с разл.), C5H5N∙HCl∙2HgCl2 (т пл. 177–178 °C).
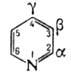
Обладает ароматич. свойствами; содержит 6p-электронов, образующих единую замкнутую систему, в которой из-за отрицат. индукц. эффекта атома N электронная плотность у атомов С, особенно в положениях 2, 4 и 6, понижена (π-дефицитный гетероцикл).
Электроф. замещение протекает с большим трудом (П. по способности к электроф. замещению близок к нитробензолу) и идет в положение 3. Большинство этих реакций протекает в кислой среде, в которой исходным соед. является уже не сам П., а его соль. П. нитруется лишь под действием NaNO3 или KNO3 в дымящей H2SO4 при температуре 300 °C, образуя с небольшим выходом 3-нитропиридин; сульфируется олеумом в присутствии сульфата Hg при 220–270 °C до пиридин-3-сульфокислоты. При действии на П. ацетата ртути при 155 °C образуется 3-пиридилмеркурацетат; при более высоких температурах-ди- и полизамещенные производные. Действие Br2 в олеуме при 300 °C приводит к смеси 3-бром- и 3,5-дибром-пиридинов. При более высокой температуре (ок. 500 °C) реакция идет но радикальному механизму; продукты реакции — 2-бром- и 2,6-дибромпиридины. К радикальным реакциям относится и взаимодействие П. с фенилдиазонийгидратом (реакция Гом-берга-Бахмана-Хея), в результате чего образуется смесь, содержащая 55% 2-фенил-, 30% 3-фенил- и 15% 4-фенил-пиридина.
Нуклеоф. замещение в П. протекает по положениям 2 и 4 и легче, чем в бензоле, напр., синтез 2-аминопиридина при взаимодействии П. с амидом натрия (см. Чичибабина реакция).
П., как правило, устойчив к окислителям, однако при действии надкислот легко образует N-оксид пиридина (см. аминов N-оксиды) в котором электронная плотность на атомах С-2 и С-4 повышена по сравнению с П. При 300 °C под действием FeCl3 П. окисляется в смесь изомерных дипири-дилов общей формулы C5H4N—C5H4N. Каталитич. гидри-рование в присутствии Pt или Ni, восстановление Na в спирте, а также электрохим. восстановление приводит к пиперидину (последний способ применяется в промышленности). Более жесткое восстановление П. сопровождается расщеплением цикла и дезаминированием.
Присоединение карбенов к П. или депротонирование ионов N-алкилпиридиния приводит к илидам пиридиния общей формулы I, взаимодействие П. с нитренами или депротонирование солей N-аминопиридиния — к иминам пиридиния общей формулы II.
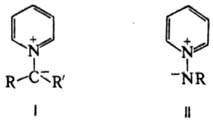
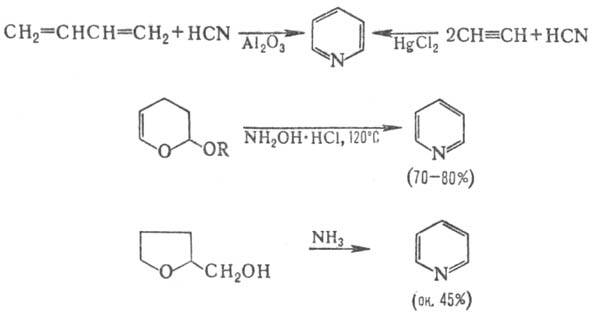
Соед. обоих типов легко вступают в реакции циклоприсоединения, характерные для 1,3-диполярных систем. П. выделяют гл. обр. из каменноугольной смолы (содержание ок. 0,08%), продуктов сухой перегонки дерева, торфа или кости. Синтетически он м. б. получен след. реакциями:
П. и его производные-основа пиридиновых алкалоидов, а также мн. лекарственных средств. Используют П. также в синтезе красителей, инсектицидов, применяют для денатурации спирта. Комплекс П. с SO3-пиридинсульфотриоксид-мягкий сульфирующий агент; C5H5NBr2∙HBr-бромирующий агент; C5H5N ∙ HCl-реагент для дегидратации эпоксидов и N-деал-килирования, C5H5N∙H2Cr2O7-окислитель. П. — хороший растворитель, в т. ч. для мн. неорг. солей (AgBr, Hg2Cl2 и др.). ПДК паров П. в воздухе ~ 0,005 мг/л, т. воспл. 23,3 °C.
П. впервые выделен T. Андерсеном в 1849 из костяного масла; структура П. установлена Дж. Дьюаром и P. Кернером в 1869.
О производных П. см. лутидины, оксипиридины, пиколины, пиридиния соли.
Лит.: Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 15–117; Pyridine and its derivatives. Suppl. ed. by R. A. Abramovitch, pt 1–4, N. Y., 1974; Pyridine and its derivatives, ed by E. Klingsberg, pt 1–4, L. — N. Y. — Sydney, 1960–64.
Л. Н. Яхонтов
Значения в других словарях
- Пиридин — Гетероциклическое соединение, бесцветная жидкость с характерным запахом; tпл —41,6°С, tкип 115,3°С, плотность 0,9832 г/см3 (20°С); смешивается во всех соотношениях с водой и большинством органических растворителей. Большая советская энциклопедия
- пиридин — орф. пиридин, -а Орфографический словарь Лопатина
- ПИРИДИН — ПИРИДИН, гетероциклическое соединение (C5H5N), характеризующееся шестичленной кольцевой структурой, состоящей из пяти атомов УГЛЕРОДА и одного атома АЗОТА. Научно-технический словарь
- пиридин — [< гр. огонь] – органическое соединение, получаемое из каменноугольной смолы; применяется для денатурирования спирта, изготовления красителей, в качестве растворителя и т.д. Большой словарь иностранных слов
- Пиридин — С5Н5N. — Это вещество вместе с целым рядом аналогичных ему соединений, вообще называемых пиридиновыми основаниями, было открыто в 1846 г. Андерсоном при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей. Энциклопедический словарь Брокгауза и Ефрона
- ПИРИДИН — ПИРИДИН — бесцветная жидкость с неприятным запахом, tкип 115,4 °С. Содержится в каменноугольной смоле. Применяют в синтезе лекарственных средств, гербицидов, для денатурирования этилового спирта, как растворитель. Большой энциклопедический словарь
