эфиры сложные
ЭФИРЫ СЛОЖНЫЕ
продукты замещения атомов водорода групп OH в минер. или карбоновых кислотах на углеводородные радикалы. Для многоосновных кислот различают полные и кислые эфиры (напр., ROSO2OR' и ROSO2OH, ROCOCH2COOR' и ROCOCH2COOH соотв., где R, R' — алкил, арил, гетерил). Строение Э. с. может быть представлено двумя резонансными структурами:

Эфирная группировка планарна или близка к планарной: простая связь С — О (структура I) имеет конформацию с цисоидным расположением карбонильной двойной связи и связи О — R. Длина связи С = О в разл. Э. с. 0,119–0,122 нм, связи С — О 0,131–0,136 нм, углы ОСО 122–126°, СОС 113–118°.
По номенклатуре ИЮПАК названия Э. с. производят от назв. апкильной или арильной группы гидроксильного компонента и названия кислоты путем замены окончания "овая" на суффикс "ат", напр.: C2H5COOC2H5 — этилпропионат, CH3OSO2OH — метилсульфат. Некоторые Э. с. имеют тривиальные названия.
Э. с. — главная составная часть жиров, восков, спермацета; входят в состав мн. эфирных масел.
Физические свойства. Э. с. низших карбоновых кислот и простейших спиртов — бесцв. летучие жидкости, часто с приятным фруктовым запахом; Э. с. высших карбоновых кислот — твердые бесцв. вещества, почти лишенные запаха. Низшие Э. с. минеральных кислот (алкилсульфиты, алкилсульфаты, алкилбораты) — маслянистые жидкости с приятным запахом; алкилсульфаты, начиная с C9H17,- твердые соед. Температуры кипения Э. с. низших спиртов ниже, чем соответствующих кислот; температуры кипения сульфитов обычно ниже, чем сульфатов. Э. с. плохо раств. в воде, хорошо — в органических растворителях, обладают значит. дипольным моментом (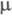 5,67∙10−30-6,66∙10−30 Кл∙м).
5,67∙10−30-6,66∙10−30 Кл∙м).
В ИК спектрах Э. с. присутствуют характеристич. полосы в области 1750–1700 см−1 (валентные колебания группы С = О) и 1275–1050 см−1 (валентные колебания группы С — О). В УФ спектрах наблюдаются слабые полосы при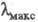 195–210 нм
195–210 нм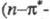 переход); для
переход); для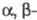 ненасыщ. эфиров сильные полосы при
ненасыщ. эфиров сильные полосы при 210 нм
210 нм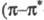 -переход), по мере увеличения ненасыщенности полоса сдвигается в длинноволновую область. В спектрах ПМР хим. сдвиг
-переход), по мере увеличения ненасыщенности полоса сдвигается в длинноволновую область. В спектрах ПМР хим. сдвиг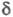 3,7–4,1 м. д. ( α-Н-атом спиртового остатка) и
3,7–4,1 м. д. ( α-Н-атом спиртового остатка) и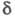 2–2,2 м. д. (
2–2,2 м. д. (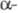 Н-атом кислотного остатка).
Н-атом кислотного остатка).
Химические свойства. Большинство реакций Э. с. связано с нуклеоф. атакой по карбонильному атому углерода и замещением алкоксигруппы:
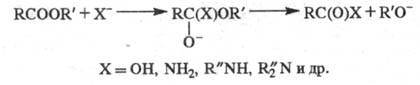
Гидролиз Э. с. протекает как в кислой (минер. кислоты), так и в щелочной среде [водные или спиртовые растворы NaOH, КОН, а также Ba(OH)2, Ca(OH)2]:
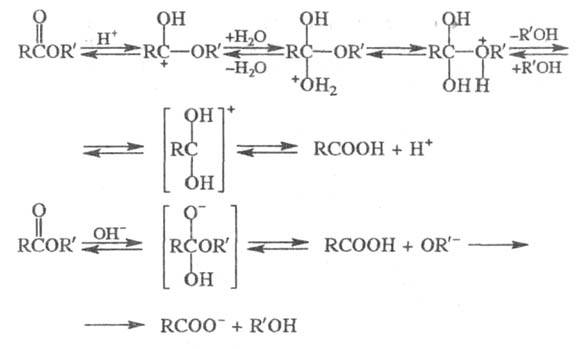
Кислотный гидролиз — обратимый процесс, щелочной — практически необратим, т. к. карбоксилат-анион RCOO− не м. б. атакован нуклеофилом. Скорость гидролиза увеличивается с повышением температуры и с увеличением мол. массы эфира. Многие Э. с. (гл. обр. жиры) гидролизуются под действием ферментов.
При взаимодействии Э. с. со спиртами происходит переэтерификация (см. ниже); кат. — H2SO4 или сухой HCl либо алкоголят-ион. Аммонолиз и аминолиз Э. с. приводит соотв. к амидам RCONH2 и N-замещенным амидам RCONR'R"; катализаторами служат чаще всего NH4C1 или CH3OК, растворителями — диэтиловый эфир, бензол или сам амин (для ароматич. аминов). Низкомол. Э. с. реагируют с NH3 при комнатной температуре, высокомол. — при повышенных температуре и давлении. Иногда аммонолиз проводят при низкой температуре, чтобы избежать побочных реакций, напр.:
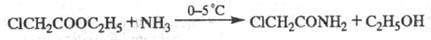
Особенно легко протекает внутримол. аминолиз; напр.,  аминоэфиры циклизуются уже при комнатной температуре, давая пирролидоны:
аминоэфиры циклизуются уже при комнатной температуре, давая пирролидоны:

При взаимодействии Э. с. с NH2OH образуются гидроксамовые кислоты RCONHOH, с гидразином — гидразиды RCONHNH2, с ацеталями или карбоновыми кислотами в присутствии минер. кислот происходит обменная реакция (см. ацидолиз).
Реакции Э. с. с реактивами Гриньяра и др. металлоорг. соед. приводят к образованию третичных спиртов (за исключением фэрмиатов, которые дают вторичные спирты):
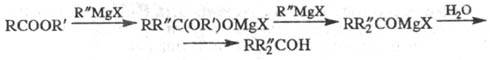
Э. с. вступают в сложноэфирную конденсацию с соед., содержащими активную метиленовую группу (см. Клайзена конденсация), диэфиры двухосновных кислот претерпевают внутримол. конденсацию (см. Дикмана реакция).
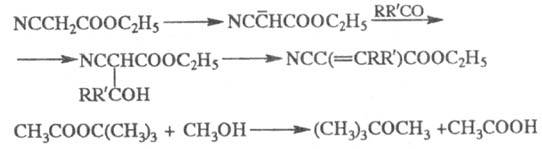
Э. с., образующие стабильные карбанионы и не проявляющие тенденции к самоконденсации, легко алкилируются; некоторые из таких эфиров вступают в реакции с разрывом связи алкил-кислород, напр.:
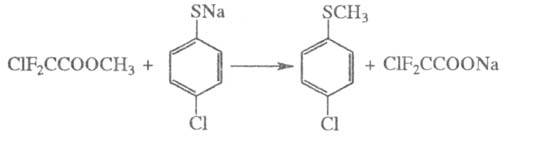
Э. с. минер. и фторзамещенных карбоновых кислот алкилируют разл. соед. в щелочной среде, напр.:
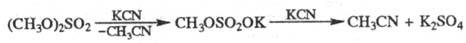
При температуре выше 300 °C Э. с. разлагаются с образованием алкенов, пиролиз ацетатов проводят в газовой фазе при 500–600 °C:
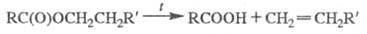
Пиролиз Э. с. жирных кислот в присутствии некоторых металлов (Mg, Zn) или их оксидов приводит к кетонам:
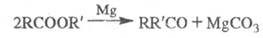
Бензоаты и оксалаты разлагаются при более низких температурах в жидкой фазе.
Э. с. устойчивы к действию окислителей. Восстановление Э. с. (Na в этаноле, LiAlH4, A1H3 и др.) приводит к альдегидам, но обычно восстановление идет дальше — до первичного спирта: 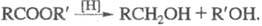 Каталитич. гидрирование Э. с. в присутствии хромата (III) меди при температуре 200–300 °C и давлении 10–30 МПа — пром. способ получения спиртов. При восстановлении эфиров алифатич. моно- и дикарбоновых кислот Na в кипящем ксилоле образуются ацилоины (см. ацилоиновая конденсация).
Каталитич. гидрирование Э. с. в присутствии хромата (III) меди при температуре 200–300 °C и давлении 10–30 МПа — пром. способ получения спиртов. При восстановлении эфиров алифатич. моно- и дикарбоновых кислот Na в кипящем ксилоле образуются ацилоины (см. ацилоиновая конденсация).
Получение. Наиб. широко применяют этерификацию — взаимод. спиртов с кислотами: RCOOH + R'OH RCOOR' + H2O. Это — обратимая реакция, в которой положение равновесия зависит от природы и количества кислоты и спирта и характеризуется равновесной концентрацией продуктов этерификации (т. наз. предел этерификации), напр. при эквимол. соотношении CH3COOH и C2H5OH равновесие устанавливается, когда ~2/3 кислоты и спирта превращается в эфир. На скорость достижения предела этерификации влияют температура и катализаторы (сильные кислоты и их ангидриды, арилсульфоновые кислоты, кислые соли и кислые катионообменные смолы). Для повышения выхода воду из реакц. среды удаляют азеотропной дистилляцией. Легче всего этерифицируются первичные спирты, наиб. трудно — третичные.
RCOOR' + H2O. Это — обратимая реакция, в которой положение равновесия зависит от природы и количества кислоты и спирта и характеризуется равновесной концентрацией продуктов этерификации (т. наз. предел этерификации), напр. при эквимол. соотношении CH3COOH и C2H5OH равновесие устанавливается, когда ~2/3 кислоты и спирта превращается в эфир. На скорость достижения предела этерификации влияют температура и катализаторы (сильные кислоты и их ангидриды, арилсульфоновые кислоты, кислые соли и кислые катионообменные смолы). Для повышения выхода воду из реакц. среды удаляют азеотропной дистилляцией. Легче всего этерифицируются первичные спирты, наиб. трудно — третичные.
Этерификацией наз. также методы получения Э. с. ацилированием спиртов, алкилированием кислот диазоалканами либо солей алкилгалогенидами.
Другой распространенный способ получения Э. с- переэтерификация — замена одного спиртового или кислотного остатка в молекуле Э. с. на другой. Осуществляют реакцию взаимод. Э. с. со спиртами, карбоновыми кислотами или др. Э. с. в присутствии алкоголятов, щелочей, HCl, BF3, солей некоторых металлов, напр.:
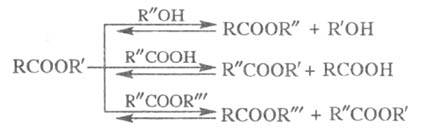
Равновесие смещают вправо путем отгонки более летучих спирта, кислоты или эфира. Метод используют для получения Э. с., которые нельзя получить этерификацией, напр. виниловые или изопропиловые эфиры высших кислот.
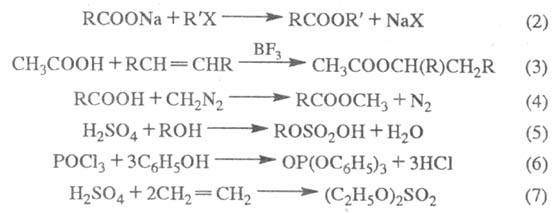
Э. с. образуются также кислотным алкоголизмом нитрилов (кат. — H2SO4, HCl, n-толуолсульфокислота; реакция 1); алкилированием карбоксилат-анионов (кислот или их солей) алкилгалогенидами, алкенами в присутствии катализаторов (2,3); из альдегидов по Тищенко реакции; метиловые эфиры — реакцией кислот с диазометаном (4); эфиры минеральных кислот — взаимод. последних, а также их галогенангадридов со спиртами или фенолами (5,6) либо минеральных кислот с олефинами (7):
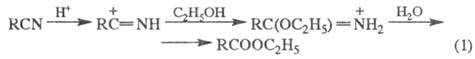
Для получения Э. с. используют окисление: кетонов H2O2 или надкислотами (Байера-Виллигера реакция), ацетиленовых производных (8), соед., содержащих аллильную группу (9) и др.:
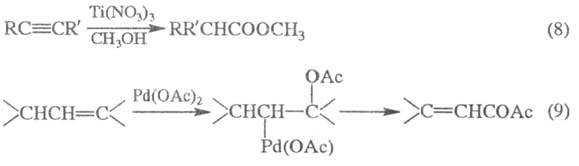
Э. с. высших дикарбоновых кислот получают из солей кислых эфиров дикарбоновых кислот в условиях электрохим. реакции Кольбе:
2ROOC(CH2)nCOONa ROOC(CH2)2nCOOR
ROOC(CH2)2nCOOR
Э. с. серной и фосфорной кислот образуются при окислении соответствующих сульфитов и фосфитов.
Определение. Для обнаружения Э. с. используют их реакцию с гидроксиламином: образующиеся гидроксамовые кислоты дают с FeCl3 характерное красное окрашивание, для определения — кислотное число и эфирное число, а также методы хроматографии.
Применение. Э. с. — растворители, пластификаторы, экстрагенты, лек. средства (напр., нитроглицерин), сырье для синтеза полимеров (напр., метилметакрилат) и фармацевтич. препаратов (напр., производных салициловой кислоты). Э. с. серной кислоты используют как алкилирующие агенты; Э. с. фосфорной кислоты — инсектициды, флотореагенты, присадки к маслам; низшие Э. с. карбоновых кислот применяют в парфюмерии и пищ. промышленности.
• см. также ацетоуксусный эфир, винилацетат, глицериды, метилметакрилат, этилацетат и др.
Лит.: Вейганд-Хильгетаг, Методы эксперимента в органической химии, пер. с нем., М., 1968; Общая органическая химия, пер. с англ., т. 4, М., 1983, с. 288–388; Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980, p. 311–37.
Л. Н. Максимова
Значения в других словарях
- Эфиры сложные — Органические соединения, производные кислот, в молекулах которых гидроксильная группа OH замещена на остаток спирта, енола (См. Енолы) или Фенола — OR, например C2H5OCOCH3, C5H11ONO. Э. с. являются структурными аналогами солей (См. Большая советская энциклопедия
- ЭФИРЫ СЛОЖНЫЕ — ЭФИРЫ СЛОЖНЫЕ, вещества из класса органических соединений, которые образуются в результате реакции между СПИРТАМИ и КИСЛОТАМИ. Научно-технический словарь
- ЭФИРЫ СЛОЖНЫЕ — ЭФИРЫ СЛОЖНЫЕ — органические соединения, продукты замещения атомов водорода групп ОН в минеральных или карбоновых кислотах на органические радикалы. Растворители (напр., этилацетат) — пластификаторы, экстрагенты, сырье для синтеза полимеров (напр. Большой энциклопедический словарь
- Эфиры сложные — (хим.) — представляют собой сочетания спиртов с кислотами, происходящие путем выделения воды за счет водных остатков этих соединений. Названия [В немецкой химической литературе сложные... Энциклопедический словарь Брокгауза и Ефрона
