ацилоиновая конденсация
АЦИЛОИНОВАЯ КОНДЕНСАЦИЯ
образование α-гидроксикетонов (ацилоинов) восстановлением эфиров алифатич. моно- или дикарбоновых кислот, напр.:
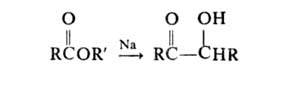
А.к. эфиров монокарбоновых кислот осуществляется двумя путями:
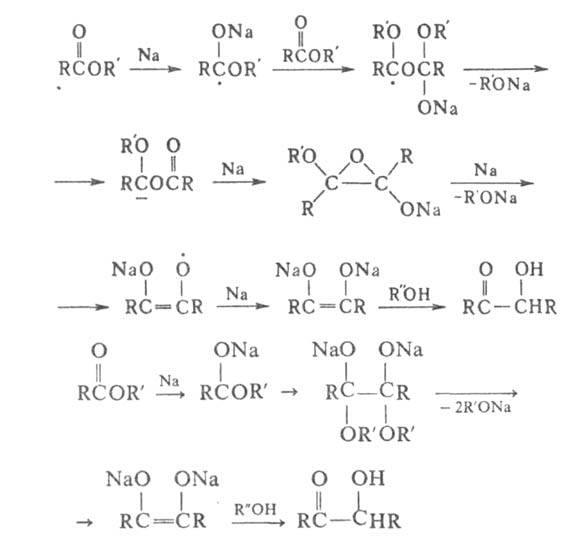
Сложный эфир нагревают с Na (мольное соотношение 1:2) в бескислородной атмосфере в инертных растворителях, напр. в бензоле, толуоле, ксилоле. Применение вместо Na жидкого сплава его с К позволяет проводить процесс при комнатной температуре. Для повышения выхода ацилоинов в реакции используют (CH3)3SiCl; образующиеся при этом бис-триметилсилиловые эфиры ендиолов легко выделяются и при взаимодействии со спиртом образуют ацилоины. При осуществлении А.к. без (CH3)3SiCl получаются побочные продукты-1,2-дикетоны, кетоны, а также вещества, синтезирующиеся в результате конденсации Дикмана и Клайзена.
С помощью А. к. можно получать с хорошими выходами ациклич. ацилоины с R от CH3 до C22H45. Реакция с участием эфиров двух разных монокарбоновых кислот практически не осуществляется.
Из эфиров дикарбоновых кислот в условиях, при которых происходит А. к. монокарбоновых кислот, образуются циклич. ацилоины:
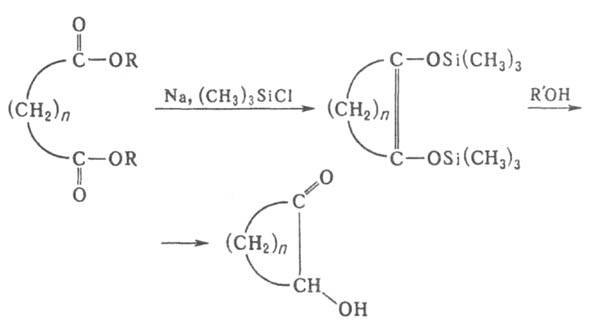
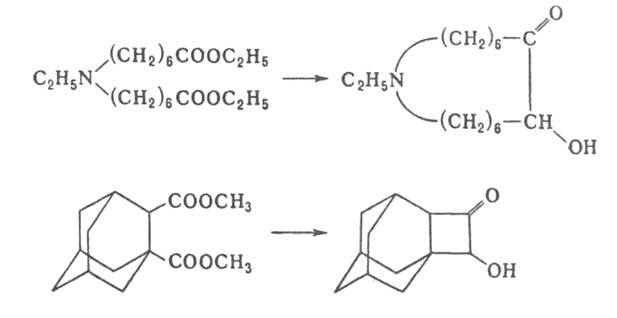
Таким путем можно получить ацилоины, содержащие в цикле от 4 до 42 атомов С. Эту же реакцию используют для синтеза макроциклических гетероциклических ацилоинов и ацилоинов с конденсированными циклами, напр.:
В результате А. к. эфира дикарбоновой кислоты, содержащей 34 атома С, в присутствии 34-членного циклоалкана удалось получить катенан. А.к. — промежут. реакция при получении макроциклич. углеводородов, макроциклич. и ациклич. кетонов, α-дикетонов и диолов.
Лит.: Bloomfield J.J. [а.о.], в кн.: Organic reactions, v. 23, N.Y.-L., 1976, p. 259–403.
Н. П. Гамбарян
