МОЛЕКУЛА
(новолат. molecule, уменьшит. от лат. moles — масса), наименьшая ч-ца в-ва, обладающая его осн. хим. св-вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч (нек-рые витамины, гормоны и белки). Атомы инертных газов часто называют одноатомными М., хотя, строго говоря, они не явл. М. Если М. состоит из тысяч и более повторяющихся единиц (одинаковых или близких по строению групп атомов), то её называют макромолекулой. В физике представление о М. возникло в 18 в. и получило широкое признание в 19 в. в связи с развитием термодинамики и теории газов и жидкостей. Во 2-й половине 19 в. с помощью разл. хим. методов были получены мн. важные сведения о строении М. Окончательно существование М. было подтверждено опытами франц. физика Ж. Б. Перрена по изучению броуновского движения (1906).
Атомы в М. связаны между собой в определ. последовательности и определ. образом расположены в пр-ве. Наиб. общие хар-ки М.— мол. масса, состав и структурная ф-ла, указывающая последовательность хим. связей (напр., мол. масса М. воды 18, равная сумме масс входящих в неё атомов в атомных единицах массы, состав Н2О, структурная ф-ла Н—О—Н). Прочность межатомной связи характеризуется энергией хим. связи, к-рая составляет обычно неск. десятков кДж/моль. Атомы в М. непрерывно совершают колебат. движения; при определ. условиях, напр. в газовой фазе, М. могут совершать поступат. и вращат. движения. М., как и атомы, не имеют чётких границ. Размеры М. можно ориентировочно оценить, зная плотность в-ва, мол. м. и число Авогадро. Так, если допустить, что М. Н2O имеет сферич. форму, то диаметр её окажется равным =3•10-8 см (0,3 нм). Размеры М. растут с увеличением числа атомов в них и лежат в пределах 10-8—10-5 см. М. нельзя увидеть невооружённым глазом или с помощью оптич. микроскопа, однако существование М. доказывают мн. явления (броуновское движение, диффузия, дифракция рентг. лучей, эл-нов, нейтронов и т. д.).
Устойчивость М. в среде зависит от её вз-ствия с др. атомами, а также от темп-ры, давления и др. внеш. факторов. В газообразном состоянии в-во, как правило, состоит из М. (кроме инертных газов, паров металлов). При достаточно высоких темп-pax М. всех газов распадаются на атомы. В конденсированных системах М. могут сохраняться. Вода во всех агрегатных состояниях состоит из М.; из М. построены большинство жидкостей и молекулярные кристаллы. В металлах и др. ат. кристаллах, а также их расплавах М., как правило, не существуют, т. к. в них каждый атом взаимодействует со всеми соседними приблизительно одинаково.
Химическая связь.
Возможность образования М. объясняется тем, что внутр. энергия М. как системы атомов ниже суммарной энергии этих атомов в изолиров. состоянии. Соответствующая разность энергии наз. энергией образования М. из атомов (или энергией атомизации), к-рая приближённо равна сумме энергий хим. связей.
Для хим. связи существ. значение имеют лишь эл.-магн. вз-ствия эл-нов и ядер входящих в М. атомов. Наиболее часто встречаются М., в к-рых существуют ковалентные и ионные хим. связи.
К о в а л е н т н а я с в я з ь возникает при обобществлении эл-нов (обычно электронных пар) двумя соседними атомами (т. е. за счёт обмена эл-нами). Хим. связь такого типа осуществляется в М. Н2, O2, СО и др. При сближении атомов ковалентная связь образуется только в том случае, когда спины их внеш. эл-нов антипараллельны. При этом происходит деформация электронных оболочек атомов, их перекрытие по линии, соединяющей ядра. При нек-ром межъядерном расстоянии силы притяжения уравновешиваются силами отталкивания и образуется устойчивая система, внутр. энергия к-рой минимальна.
Ионная связь осуществляется электростатич. вз-ствием атомов при переходе эл-на одного из них к другому, т. е. при образовании положит. и отрицат. иона. Такая связь характерна для М. NaCl, KI и др. Ковалентные и ионные хим. связи явл. предельными; как правило, образуются смешанные хим. связи — частично ковалентные, частично ионные.
Внутренняя энергия и уровни энергии молекул.
Внутр. энергия М.— осн. хар-ка, определяющая её состояние и св-ва и зависящая от взаимного расположения составляющих её ч-ц и их движения. М. явл. квант. системой, и её внутр. энергия ? может принимать лишь определ. значения, т. е. квантуется. Внутр. энергия М. приближённо равна сумме энергий электронных движений ?э, колебаний ядер ?к и вращения М. как целого ?в, т. е. ?»?э+?к+?в, причём ?э->?к->?в. Каждая из указанных энергий квантуется в соответствии с законами квантовой механики, и ей соответствует набор дискретных уровней энергии (электронные, колебат. и вращат. уровни энергии).
Состояние М. как квант. системы описывается Шредингера уравнением, к-рое учитывает электростатич. вз-ствия эл-нов с ядрами, эл-нов друг с другом, а также кинетич. энергию эл-нов и ядер. В адиабатическом приближении ур-ние Шредингера для М. распадается на два ур-ния — для эл-нов и для ядер. Решение (обычно приближённое) электронного ур-ния Шредингера — нахождение уровней энергии эл-нов — одна из осн. задач квантовой химии.
М.— электрически нейтральные системы, однако электронная плотность в них распределена неравномерно. Число электронных уровней в М. значительно больше числа уровней энергии составляющих М. атомов, поскольку каждый атом М. находится в электрич. поле остальных атомов, в результате чего уровни расщепляются на многочисл. подуровни (Штарка эффект).
Электронные уровни М. определяются совокупностью квантовых чисел, характеризующих состояния всех эл-нов М. Уровни, отвечающие значениям квант. числа L=0, 1, 2, ... полного орбит. момента М обозначаются соответственно S, П, D, ... (L представляет собой сумму орбитальных квант. чисел эл-нов; (см. АТОМ)). Квант. число S=0, 1, 2, ... определяет полный спиновый момент, внутр. квант. число W=Lr±S— полный момент М. Электронный уровень М. обозначают 2S+1LW, где слева вверху приводится мультиплетность уровня c=2S+1.
Ур-ние Шредингера для ядер содержит информацию о колебаниях М. и вращениях её как целого. Решение этого ур-ния для двухатомной М. приводит к дискретным колебат. уровням, отстоящим один от другого на hv, если колебания ядер считать гармоническими (v — собств. частота осциллятора), и на hv-2(v+1)hva — при ангармонич. колебаниях (v — колебательное квант. число, а — постоянная ангармоничности). Колебания реальных двухатомных М. ангармоничны, и расстояние между колебат. уровнями энергии убывают с ростом v, а макс. колебат. энергия равна энергии диссоциации М.
В многоатомной М. как связанной системе ч-ц колебания отд. атомов не независимы. Сложные колебания такой системы можно разделить на независимые гармонич. колебания, каждое из к-рых характеризуется определ. частотой; их называют н о р м а л ь н ы м и к о л е б а н и я м и.
Колебания многоатомных М. в принципе могут быть изучены теоретически с помощью методов квант. химии, однако на практике обычно пользуются механич. моделью, оперирующей силовыми постоянными разл. структурных элементов М.
Вращат. уровни двухатомной М. определяются выражением
?в= h2J(J+1)/8p2I,
где I — момент инерции М., относительно нек-рой оси вращения, J — вращат. квант. число.
Аналогичные ф-лы, выведенные для многоатомных М., позволяют определять их геометрию по наблюдаемым чисто вращат. спектрам. Выражение для ?в резко усложняется, если, помимо вращения М. как целого, имеет место внутр. вращение, приводящее к ротамерам (см. ниже). Однако ф-лы для ?в дают возможность на основании вращат. спектров оценивать барьеры внутр. вращения и др. хар-ки М. Наряду с чисто электронными, колебат. и вращат. уровнями энергии в спектрах проявляются уровни, обусловленные электронно-колебат. и колебательно-вращат. вз-ствиями.
Спектры излучения, поглощения, комбинац. рассеяния света возникают при переходах М. с одного уровня энергии на другой; при этом М. поглощает или излучает энергию, равную разности энергий этих уровней. Соответственно возникают электронные, колебат. и вращат. спектры М. (подробнее (см. МОЛЕКУЛЯРНЫЕ СПЕКТРЫ)).
Структура молекулы. Геометрию М. можно описать декартовыми координатами атомов, однако чаще всего её характеризуют набором внутр. параметров — д л и н с в я з е й, в а л е н т н ы х и д в у г р а н н ы х у г л о в. Длиной связи наз. расстояние между ядрами атомов, соединённых между собой хим. связью. Обычно, чем больше длина связи, тем меньше её прочность.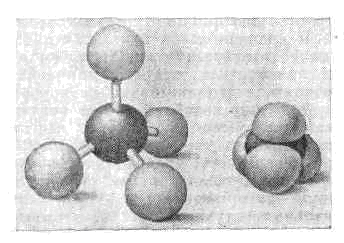
Трёхмерные модели молекул: слева — шаро-игловая модель: атомы изображены белыми шарами, валентные связи — выходящими из них стержнями; справа — объёмная модель Стюарта—Бриглеба: атомы представлены шарами, радиусы к-рых пропорц. ван-дер-ваальсовым радиусам.
Валентным наз. угол между двумя хим. связями, выходящими из одного атома. Торсионные углы — это углы вращения вокруг связей. Так, в М. перекиси водорода, Н—О—О — Н, длины связей О—О и О—Н равны соотв. 0,147 и 0,095 нм, валентный угол Н—О—О равен 95° и торсионный угол (угол вращения вокруг связи О—О, или двугранный угол между плоскостями Н—О—О и О—О—Н) равен 112°.
Каждое электронное состояние характеризуется равновесной геометрией (равновесной конфигурацией), отвечающей мин. энергии. В обычных условиях М. находится в основном электронном состоянии (на ниж. электронном уровне), и термин «равновесная конфигурация» часто относят только к этому состоянию. Так, приведённые выше внутр. геом, параметры М. Н—О — О — Н явл. равновесными, тогда как, напр., плоские формы этой М. (торсионный угол равен 0 или 180°) неравновесны. Зависимость внутр. энергии М. от геом. параметров для многоатомных М. может быть представлена многомерной поверхностью, наз. потенциальной поверхностью. Самый глубокий минимум потенц. энергии М. соответствует её равновесной конфигурации, метастабильным состояниям отвечают менее глубокие минимумы. Определение потенц. поверхности М. или хотя бы выявление нек-рых её особенностей явл. целью разл. эксперим. и теоретич. исследований.
Расположение атомов в М. всегда обладает определённой симметрией (см. СИММЕТРИЯ МОЛЕКУЛЫ). Потенц. поверхность М. также обладает симметрией, что проявляется, напр., в инфракрасных спектрах М. или спектрах комбинационного рассеяния света.
Нек-рые одинаковые по составу М. могут отличаться строением или расположением атомов. Такие формы существования в-ва наз. изомерами (см. ИЗОМЕРИЯ МОЛЕКУЛ). Структурные изомеры имеют разную последовательность хим. связей, и их М. изображаются разными структурными ф-лами (напр., нормальный бутан Н3С—СН2—СН2—СН3 и изобутан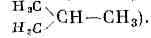
Структурные изомеры — это разные М., а соответствующие соединения обладают разными физ. и хим. св-вами. Так, темп-ра кипения нормального бутана равна +0,6 °С, а изобутана -11,7 °С.
Поворотные изомеры (р о т а м е р ы, к о н ф о р м е р ы) возникают при вращении атомов или ат. групп вокруг хим. связей и отвечают разным минимумам потенц. поверхности М. Они представляют собой разл. состояния одной и той же М. Энергетич. барьеры, разделяющие поворотные изомеры, не превышают 100 кДж/моль, а время жизни этих изомеров обычно =10-10—10-13 с. При более высоких энергетич. барьерах (напр., при геом. изомерии М.) время жизни изомеров возрастает и появляется возможность их разделения.
М. оптических изомеров энантиоморфны — зеркально симметричные одна по отношению к другой. Такие изомеры вращают плоскость поляризации света в противоположные стороны; остальные же физ. св-ва у них совершенно одинаковы (см. ОПТИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА).
Свойства молекул. Исследование молекул.
Хим. и большинство физ. св-в М. определяются их внеш. эл-нами. Так, внеш. эл-ны определяют оптич. спектры М. В спектрах М. проявляются мн. особенности их строения (симметрия, изомерия, природа хим. связи и т. д.). Индивидуальность спектров соединений, характеристичность частот колебаний определ. групп атомов в М. позволяют производить качеств. и количеств. спектральный анализ в-ва. Электронные уровни энергии изучают методами ультрафиолетовой спектроскопии, фотоэлектронной спектроскопии, рентгеноэлектронной спектроскопии. Колебат. уровни энергии проявляются в ИК спектрах и спектрах комбинац. рассеяния света. Частоты вращат. линий лежат в радиодиапазоне (см. МИКРОВОЛНОВАЯ СПЕКТРОСКОПИЯ), а также в дальней ИК области спектра.
Во внеш. электрич. поле М. поляризуется — приобретает индуциров. дипольный момент (см. ПОЛЯРИЗУЕМОСТЬ АТОМОВ, ИОНОВ, МОЛЕКУЛ). Поляризация в-в из полярных М. (т. е. М., обладающих пост. дипольными моментами) во внеш. электрич. поле обусловлена как их ориентацией вдоль поля, так и возникновением индуциров. дипольных моментов за счёт электронной поляризуемости. Измерение диэлектрич. проницаемости и поляризации в-ва даёт возможность приблизительно оценивать поляризуемость и величину пост. дипольных моментов отд. М., что позволяет делать выводы о её строении — симметрии, распределении электронной плотности, присутствии тех или иных групп атомов и их расположении и т. д.
Магн. св-ва М. дают важные сведения о строении электронной оболочки. Большинство М. диамагнитны, т. е. не имеют пост. магн. момента. Поведение таких М. в магн. поле определяется их отрицат. магнитной восприимчивостью. Парамагн. М., обладающие пост. магн. моментом, во внеш. магн. поле стремятся ориентироваться в направлении поля. Пост. магн. моментом (связанным со спином эл-нов, а также с их орбит. движением) могут обладать как электронная оболочка, так и ат. ядра. Парамагнитные (обладающие неспаренным эл-ном) М. исследуют с помощью электронного парамагнитного резонанса. В спектрах ядерного магнитного резонанса проявляются вз-ствия спиновых моментов ат. ядер, зависящие от электронной структуры М. и окружения каждого атома. На основании спектров ЯМР судят о направлении хим. связей, различных проявлениях изомерии М., взаимном расположении атомов в М., о динамике атомов в М. и т. д.
Важный метод изучения М.— массспектроскопия. Масс-спектрометрич. измерения основаны на расщеплении М. на электрически заряж. фрагменты (радикалы) и определении масс этих фрагментов. Геометрию М. в кристаллах определяют с помощью дифракции рентг. лучей (см. РЕНТГЕНОВСКИЙ СТРУКТУРНЫЙ АНАЛИЗ) и нейтронов (см. НЕЙТРОНОГРАФИЯ). В газовой фазе и парах геометрию М. исследуют с помощью дифракции эл-нов (см. ЭЛЕКТРОНОГРАФИЯ) и микроволновых спектров. Эти исследования дают точность в определении координат атомов (ядер) порядка 0,001 нм; отсюда точность в определении длин связей =0,001 нм и в определении валентных и двугранных углов — 1—2°. Помимо дифракц. и спектроскопич. методов, существует ещё ряд методов исследования структурных, динамич. и термодинамич. хар-к М. Так, термодинамич. методы (в частности, калориметрия) позволяют определять разность энтальпий разл. изомеров, поглощение УЗ используется для установления равновесного содержания изомеров в жидкостях и р-рах и т. д.
Значения в других словарях
- молекула — -ы, ж. Наименьшая частица вещества, обладающая всеми его химическими свойствами. [франц. molécule из лат.] Малый академический словарь
- молекула — Моле́кул/а. Морфемно-орфографический словарь
- Молекула — (новолат. molecula, уменьшительное от лат. moles — масса) наименьшая частица вещества, обладающая его химическими свойствами. М. состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов... Большая советская энциклопедия
- молекула — орф. молекула, -ы Орфографический словарь Лопатина
- молекула — МОЛЕКУЛА (новолат. molecula, уменьшит. от лат. moles — масса) микрочастица, образованная из двух или большего числа атомов и способная к самостоят. существованию. Имеет постоянный состав (качеств. и количеств.) входящих в нее атомных ядер и фиксир. Химическая энциклопедия
- молекула — МОЛЕКУЛА ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС-1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Словарь галлицизмов русского языка
- молекула — Заимств. в первой половине XIX в. из франц. яз., где molecule < н.-лат. molecula, суф. уменьшит.-ласкат. производного от moles «масса» < «усилие». Этимологический словарь Шанского
- МОЛЕКУЛА — МОЛЕКУЛА, мельчайшая частица вещества (например, химического соединения), определяющая химические свойства этого вещества. Молекула может состоять из одного атома, но обычно состоит из двух или более атомов, удерживаемых вместе ХИМИЧЕСКИМИ связями. Научно-технический словарь
- молекула — МОЛЕКУЛА -ы; ж. [франц. molécule из лат.] Наименьшая частица вещества, обладающая всеми его химическими свойствами. Образование молекул воды. Водородные связи между молекулами метанола. ◁ Молекулярный, -ая, -ое. М-ая теория. М-ое движение. М-ая масса. М. состав вещества. Толковый словарь Кузнецова
- молекула — МОЛЕКУЛА, ы, ж. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. м. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова
- молекула — Молекулы, ж. [от латин. moles – масса] (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Большой словарь иностранных слов
- молекула — МОЛ’ЕКУЛА, молекулы, ·жен. (от ·лат. moles — масса) (·ест. ). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова
- МОЛЕКУЛА — МОЛЕКУЛА (новолат. molecula, уменьшит. от лат. moles — масса) — микрочастица, образованная из атомов и способная к самостоятельному существованию. Большой энциклопедический словарь
- молекула — молекула ж. Частица вещества, обладающая всеми его химическими свойствами. Толковый словарь Ефремовой
- Молекула — Или частица — система или группа атомов; см. Вещество и др.; см. также Частица. Молекулярные, или частичные, силы и явления — см. также Частица, Сродство химическое и др. Энциклопедический словарь Брокгауза и Ефрона
