МОЛЕКУЛЯРНЫЕ СПЕКТРЫ
Спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с.— полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и ИК областях спектра; при достаточной разрешающей способности спектральных приборов мол. полосы распадаются на совокупность тесно расположенных линий. Структура М. с. различна для разл. молекул и усложняется с увеличением числа атомов в молекуле. Видимые и УФ спектры весьма сложных молекул сходны между собой и состоят из немногих широких сплошных полос. М. с. возникают при квантовых переходах между уровнями энергии ?' и ?" молекул согласно соотношению:
hv=?'-?", (1)
где hv — энергия испускаемого или поглощаемого фотона частоты v. При КРС hv равна разности энергий падающего и рассеянного фотонов. М. с. гораздо сложнее атомных спектров, что определяется большей сложностью внутр. движений в молекуле, т. к. кроме движения эл-нов относительно двух и более ядер в молекуле происходит колебат. движение ядер (вместе с окружающими их внутр. эл-нами) около положения равновесия и вращат. движения её как целого. Электронному, колебат. и вращат. движениям молекулы соответствуют три типа уровней энергии ?эл, ?кол и ?вр н три типа М. с.
Согласно квант. механике, энергия всех видов движения в молекуле может принимать только определённые значения (квантуется). Полная энергия молекулы ? приближённо может быть представлена в виде суммы квантованных значений энергий, соответствующих трём видам её внутр. движений:
?»?эл +?кол+?вр, (2) причём по порядку величины
?эл:?кол:?вр = 1: ?m/M:m/M, (3)
где т — масса эл-на, а М имеет порядок массы ядер атомов в молекуле, т.е. m/M=10-5—10-3, следовательно:
?эл -> ?кол ->?вр. (4) Обычно ?эл порядка неск. эВ (сотен кДж/моль), ?кол = 10-2—10-1 эВ, ?вр=10-5—10-3 эВ.
Система уровней энергии молекулы характеризуется совокупностями далеко отстоящих друг от друга электронных уровней энергии (разл. ?эл при ?кол=?вр=0). расположенных значительно ближе друг к другу колебательных уровней (разл. ?кол при заданном ?эл и ?вр=0) и ещё более близких друг к другу вращательных уровней (значения ?вр при заданных ?эл и ?кол).
Электронные уровни энергии а к б на рис. 1 соответствуют равновесным конфигурациям молекулы. Каждому электронному состоянию соответствует определённая равновесная конфигурация и определённое значение ?эл; наименьшее значение соответствует осн. электронному состоянию (осн. электронный уровень энергии молекулы).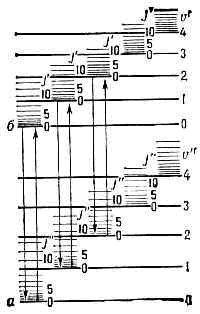
Рис. 1. Схема Уровней энергии двухатомной молекулы, а и б — электронные уровни; v' и v" — квант. числа колебат. уровней; J' и J" — квант. числа вращат. уровней.
Набор электронных состояний молекулы определяется св-вами её электронной оболочки. В принципе значения ?эл можно рассчитать методами квант. химии, однако эта задача решается только приближённо и для сравнительно простых молекул. Важную информацию об электронных уровнях молекул (их расположении и их хар-ках), определяемую её хим. строением, получают, изучая М. с.
Весьма важная хар-ка электронного уровня энергии — значение квантового числа 5, определяющего абс. величину полного спинового момента всех эл-нов. Химически устойчивые молекулы имеют, как правило, чётное число эл-нов, и для них 5 = 0, 1, 2, . . .; для осн. электронного уровня типично 5=0, для возбуждённых — 5 = 0 и 5=1. Уровни с S=0 наз. синглетными, с S=1 — триплетными (т. к. их мулътиплетность c=2S+1=3).
В случае двухатомных и линейных трёхатомных молекул электронные уровни характеризуются значением квант. числа Л, определяющего абс. величину проекции полного орбитального момента всех эл-нов на ось молекулы. Уровни с L=0, 1, 2, ... обозначаются соответственно S, П, D, . . ., а и указывается индексом слева вверху (напр., 3S, 2П). Для молекул, обладающих центром симметрии (напр., СО2, СН6), все электронные уровни делятся на чётные и нечётные (g и u соответственно) в зависимости от того, сохраняет или нет определяющая их волновая функция знак при обращении в центре симметрии.
Колебательные уровни энергии можно найти квантованием колебат. движения, к-рое приближённо считают гармоническим. Двухатомную молекулу (одна колебат. степень свободы, соответствующая изменению межъядерного расстояния r) можно рассматривать как гармонич. осциллятор, квантование к-рого даёт равноотстоящие уровни энергии: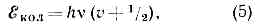
где v — осн. частота гармонич. колебаний молекулы, v=0, 1, 2, . . .— колебат. квант. число.
Для каждого электронного состояния многоатомной молекулы, состоящей из N?3 атомов и имеющей f Колебат. степеней свободы (f=3N-5 и f=3N-6 для линейных и нелинейных молекул соответственно), получается / т. н. нормальных колебаний с частотами vi(ill, 2, 3, . . ., f) и сложная система колебат. уровней энергии: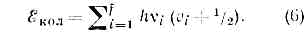
Набор частот норм. колебаний в осн. электронном состоянии явл. важной хар-кой молекулы, зависящей от её хим. строения. В определённом норм. колебании участвуют либо все атомы молекулы, либо их часть; атомы совершают гармонич. колебания с одинаковой частотой vi, но с разл. амплитудами, определяющими форму колебания. Норм. колебания разделяют по форме на валентные (изменяются длины хим. связей) и деформационные (изменяются углы между хим. связями — валентные углы). Для молекул низшей симметрии (см. СИММЕТРИЯ МОЛЕКУЛЫ) f=2 и все колебания невырожденные; для более симметричных молекул имеются дважды и трижды вырожденные колебания, т. е. пары и тройки совпадающих по частоте колебаний.
Вращательные уровни энергии можно найти квантованием вращат. движения молекулы, рассматривая её как тв. тело с определёнными моментами инерции. В случае двухатомной или линейной трёхатомной молекулы её энергия вращения ?вр=М2/2I, где I — момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М — вращат. момент кол-ва движения. Согласно правилам квантования,
M2=(h/4pi2)J(J+1),
где f=0, 1,2,. . .— вращательное квант. число; для ?вр получаем:
?вр=(h2/8pi2I)J(J+1) = hBJ(J+1), (7)
где вращат. постоянная В=(h/8piI2)I
определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний.
Разл. типы М. с. возникают при разл. типах переходов между уровнями энергии молекул. Согласно (1) и (2):
D?=?'-?"==D?эл+D?кол+D?вр,
причём аналогично (4) D?эл->D?кол->D?вр. При D?эл?0 получаются электронные М. с., наблюдаемые в видимой и УФ областях. Обычно при D??0 одновременно D?кол?0 и D?вр?0; разл. D?кол при заданном D?эл соответствуют разл. колебат. полосы (рис. 2), а разл. D?вр при заданных D?эл и D?кол отд. вращат. линии, на к-рые распадаются колебат. полосы (рис. 3).
Рис. 2. Электроино-колебат. спектр молекулы N2 в близкой УФ области; группы полос соответствуют разл. значениям Dv= v'-v".
Совокупность полос с заданным D?эл (соответствующих чисто электронному переходу с частотой nэл=D?эл/h) наз. системой полос; полосы обладают разл. интенсивностью в зависимости от относит. вероятностей переходов (см. КВАНТОВЫЙ ПЕРЕХОД).
Рис. 3. Вращат. расщепление электронно-колсбат. полосы 3805,0 ? молекулы N2.
Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу; могут накладываться друг на друга и неск. таких полос. Характерные дискретные электронные спектры наблюдаются в замороженных р-рах органич. соединений.
Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются с помощью спектральных приборов со стеклянной (видимая область) и кварцевой (УФ область, (см. УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ)) оптикой. При D?эл = 0, а D?кол?0 получаются колебат. М. с., наблюдаемые в ближней ИК области обычно в спектрах поглощения и КРС. Как правило, при заданном D?кол D?вр ?0 и колебат. полоса распадается на отд. вращат. линии. Наиболее интенсивны в колебат. М. с. полосы, удовлетворяющие условию Dv=v'- v"=1 (для многоатомных молекул Dvi=v'i- v"i=1 при Dvk=V'k-V"k=0; здесь i и k определяют разл. нормальные колебания). Для чисто гармонич. колебаний эти правила отбора выполняются строго; для ангармонич. колебаний появляются полосы, для к-рых Dv>1 (обертоны); их интенсивность обычно мала и убывает с увеличением Dv. Колебат. М. с. (точнее, колебательно-вращательные) изучают с помощью ИК спектрометров и фурье-спектрометров, а спектры КРС — при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения. При D?эл=0 и D?кол=0 получаются чисто вращат. спектры, состоящие из отд. линий. Они наблюдаются в спектрах поглощения в далёкой ИК области и особенно в микроволновой области, а также в спектрах КРС. Для двухатомных, линейных трёхатомных молекул и достаточно симметричных нелинейных молекул эти линии равноотстоят (в шкале частот) друг от друга.
Чисто вращат. М. с. изучают с помощью ИК спектрометров со спец. дифракц. решётками (эшелеттами), фурье-спектрометров, спектрометров на основе лампы обратной волны, микроволновых (СВЧ) спектрометров (см. СУБМИЛЛИМЕТРОВАЯ СПЕКТРОСКОПИЯ, МИКРОВОЛНОВАЯ СПЕКТРОСКОПИЯ), а вращат. спектры КРС — с помощью светосильных спектрометров.
Методы молекулярной спектроскопии, основанной на изучении М. с., позволяют решать разнообразные задачи химии. Электронные М. с. дают информацию об электронных оболочках, возбуждённых уровнях энергии и их хар-ках, об энергии диссоциации молекул (по схождению уровней энергии к границе диссоциации). Исследование колебат. спектров позволяет находить характеристические частоты колебаний, соответствующие наличию в молекуле определённых типов хим. связей (напр., двойных и тройных связей С—С, связей С—Н, N—Н для органич. молекул), определять пространств. структуру, различать цис- и транс-изомеры (см. ИЗОМЕРИЯ МОЛЕКУЛ). Особо широкое распространение получили методы инфракрасной спектроскопии — одни из наиболее эффективных оптич. методов изучения строения молекул. Наиболее полную информацию они дают в сочетании с методами спектроскопии КСР. Исследование вращат. спектров, а также вращат. структуры электронных и колебат. М. с. позволяет по найденным из опыта моментам инерции молекул находить с большой точностью параметры равновесных конфигураций — длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопич. молекул (в частности, молекул, в к-рых водород заменён дейтерием), имеющих одинаковые параметры равновесных конфигураций, но разл. моменты инерции.
М. с. применяются также в спектральном анализе для определения состава в-ва.
Значения в других словарях
- Молекулярные спектры — Оптические спектры испускания и поглощения, а также комбинационного рассеяния света (См. Комбинационное рассеяние света), принадлежащие свободным или слабо связанным между собой Молекулам. М. с. имеют сложную структуру. Типичные М. Большая советская энциклопедия
- молекулярные спектры — МОЛЕКУЛЯРНЫЕ СПЕКТРЫ спектры испускания и поглощения электромагн. излучения и комбинац. рассеяния света, принадлежащие свободным или слабо связанным молекулам. Имеют вид совокупности полос (линий) в рентгеновской, УФ, видимой, ИК и радиоволновой (в т. Химическая энциклопедия
- МОЛЕКУЛЯРНЫЕ СПЕКТРЫ — МОЛЕКУЛЯРНЫЕ СПЕКТРЫ — оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Большой энциклопедический словарь
