электропроводность электролитов
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ
способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы — катионы и анионы, которые существуют в растворе вследствие электролитич. диссоциации. Ионная Э. э., в отличие от электронной, характерной для металлов, сопровождается переносом вещества к электродам с образованием вблизи них новых хим. соед. (см. электролиз). Общая (суммарная) проводимость состоит из проводимости катионов и анионов, которые под действием внешнего электрич. поля движутся в противоположных направлениях. Доля общего количества электричества, переносимого отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих в переносе, равна единице.
Количественно Э. э. характеризуют эквивалентной электропроводностью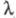 — проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина
— проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина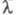 связана с уд. электропроводностью
связана с уд. электропроводностью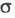 соотношением:
соотношением:
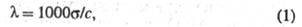
где с — концентрация раствора в г-экв/л. Эквивалентная электропроводность зависит от природы растворенного вещества и растворителя, структуры раствора, а также от концентрации, температуры, давления. Предельно разбавленному раствору, в котором все молекулы диссоциированы на ионы, соответствует предельное значение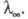 В соответствии с Кольрауша законом
В соответствии с Кольрауша законом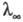 равна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в растворе и характеризует подвижность иона в растворе.
равна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в растворе и характеризует подвижность иона в растворе.
Описание концентрац. зависимости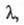 как и других свойств растворов электролитов (см. растворы электролитов), обычно базируется на ионном подходе, в рамках которого растворитель рассматривается как бесструктурная диэлектрич. среда, в которой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком растворителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в растворе определяется уравнением Стокса (см. вискозиметрия). В рамках применимости этого уравнения выполняется правило Вальдена-Писаржевского, в соответствии с которым для одного и того же электролита в любых растворителях произведение предельного значения эквивалентной электропроводности
как и других свойств растворов электролитов (см. растворы электролитов), обычно базируется на ионном подходе, в рамках которого растворитель рассматривается как бесструктурная диэлектрич. среда, в которой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком растворителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в растворе определяется уравнением Стокса (см. вискозиметрия). В рамках применимости этого уравнения выполняется правило Вальдена-Писаржевского, в соответствии с которым для одного и того же электролита в любых растворителях произведение предельного значения эквивалентной электропроводности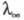 на вязкость растворителя
на вязкость растворителя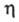 является постоянной величиной, которая не зависит от природы растворителя, но является функцией температуры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение
является постоянной величиной, которая не зависит от природы растворителя, но является функцией температуры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение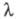 уменьшается в осн. в растворах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. электролитическая диссоциация).
уменьшается в осн. в растворах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. электролитическая диссоциация).
В растворах сильных электролитов концентрац. зависимость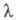 определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, которая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, которая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
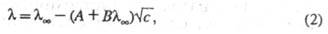
где А и В — эмпирич. постоянные, являющиеся функциями температуры, вязкости и диэлектрич. проницаемости растворителя.
Как и теория Дебая-Хюккеля, уравнение Онсагера ограничено областью умеренно разбавленных растворов. Для описания концентрир. растворов возникает необходимость в учете некулоновской части межионного взаимод., в частности в учете ионных размеров. Для этой цели применяют методы кинетич. теории ионных систем. К дополнит. уменьшению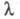 приводит образование ионных ассоциатов — пар, тройников и т. п., которое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в растворе. Для учета этого эффекта в уравнении Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов
приводит образование ионных ассоциатов — пар, тройников и т. п., которое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в растворе. Для учета этого эффекта в уравнении Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов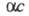 ( α- степень электролитич. диссоциации), что приводит к уравнению Фуосса — Онсагера:
( α- степень электролитич. диссоциации), что приводит к уравнению Фуосса — Онсагера:
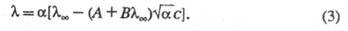
В переменных электрич. полях при достаточно высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие чего она не деформируется. Обусловленный деформацией релаксац. эффект не возникает, что приводит к увеличению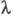 -т.наз. эффект Дебая-Фалькенхагена. Величина
-т.наз. эффект Дебая-Фалькенхагена. Величина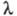 возрастает также в постоянных электрич. полях достаточно высокой напряженности (104–105 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате
возрастает также в постоянных электрич. полях достаточно высокой напряженности (104–105 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате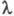 стремится к предельному значению
стремится к предельному значению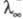 (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
(т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
Влияние температуры и давления на Э. э. обусловлено изменением предельного значения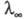 вследствие изменения структуры растворителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма Э. э. в широкой области концентраций, температур и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)=
вследствие изменения структуры растворителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма Э. э. в широкой области концентраций, температур и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)=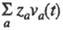 и автокорреляц. функцию
и автокорреляц. функцию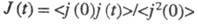 с помощью соотношения:
с помощью соотношения:

где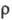 - количество ионов электролита в единице объема раствора, е -элементарный электрич. заряд,
- количество ионов электролита в единице объема раствора, е -элементарный электрич. заряд, 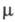 — приведенная масса катиона и аниона, za — степень окисления иона сорта a, vа(t) — его скорость в момент времени t.
— приведенная масса катиона и аниона, za — степень окисления иона сорта a, vа(t) — его скорость в момент времени t.
Специфич. механизм электропроводности характерен для кислот и оснований, содержащих соотв. ионы H+ и OH−, которые в водных растворах (или других протонных растворителях) имеют подвижность на порядок больше остальных ионов. Для объяснения аномально высокой проводимости ионов H+ и OH−предполагается, что под влиянием электрич. поля протоны перемещаются не только путем миграции, но и по механизму протонного обмена, включающему перенос протона в кислой среде от ионов гидроксония H3O+ к молекуле воды, а в щелочной — от молекулы воды к иону OH−.
Эксперим. изучение Э. э. — важное направление физико-химического анализа, поскольку зависимость Э. э. от состава раствора позволяет судить о концентрации солей, качественный, состав которых известен (см. также кондуктометрия). Измерения λ используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
М. Ф. Головко
Значения в других словарях
- Электропроводность электролитов — Обусловлена наличием в них положительных и отрицательных ионов (катионов и анионов). Доли общего количества электричества, переносимого катионами и анионами, называются переноса числами (См. Переноса число). Э. Большая советская энциклопедия
