электролитическая диссоциация
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
полный или частичный распад молекул растворенного вещества на катионы и анионы. Э. д. называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Э. д., как правило, происходит в полярных растворителях. При Э. д. разрываются обычно лишь наиб. полярные связи молекул, напр. карбоновые кислоты RCOOH диссоциируют на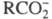 и H+. Э. д. ; могут подвергаться молекулы некоторых растворителей, напр. воды.
и H+. Э. д. ; могут подвергаться молекулы некоторых растворителей, напр. воды.
Осн. причинами Э. д. являются, с одной стороны, взаимод. растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны — значит. ослабление электро-статич. взаимод. между сольватир. ионами в среде, обусловленное ее электростатич. полем (диэлектрич. проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллич. решетки), обеспечивается за счет энергии сольватации.
Э. д. лежит в основе деления растворов на два класса — растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных свойствах разбавленных растворов электролитов и неэлектролитов объясняется тем, что из-за Э. д. увеличивается общее число частиц в растворе. Это, в частности, приводит к увеличению осмотич. давления раствора сравнительно с растворами неэлектролитов, понижению давления пара растворителя над раствором, увеличению изменения температуры кипения и замерзания раствора относительно чистого растворителя. Э. д. объясняется также ионная электропроводность электролитов.
Мерой Э. д. является степень диссоциации α- отношение количества диссоциированных на ионы молекул электролита к их исходному количеству в растворе. Согласно этому определению, 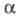 изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит от природы растворенного вещества и растворителя, а также от концентрации раствора и температуры. Как правило, с увеличением диэлектрич. проницаемости растворителя
изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит от природы растворенного вещества и растворителя, а также от концентрации раствора и температуры. Как правило, с увеличением диэлектрич. проницаемости растворителя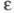 его
его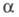 увеличивается, хотя заметная диссоциация наблюдается в некоторых растворителях с низкой
увеличивается, хотя заметная диссоциация наблюдается в некоторых растворителях с низкой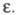
Способность данного вещества MX к Э.д. в определенном растворителе по схеме MX M+ + Х− характеризуется константой Э.д. KD, связанной, согласно действующих масс закону, со степенью диссоциации α соотношением:
M+ + Х− характеризуется константой Э.д. KD, связанной, согласно действующих масс закону, со степенью диссоциации α соотношением:

где х: — молярная концентрация электролита; 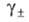 - средний ионный коэф. активности;
- средний ионный коэф. активности; 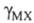 - коэф. активности недиссоциированной части электролита. Как и
- коэф. активности недиссоциированной части электролита. Как и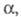 значение константы KD зависит от свойств растворенного вещества, в частности от прочности связи между фрагментами молекул электролита, образующими катион и анион, от диэлектрич. свойств растворителя, его способности сольватировать ионы, а также от температуры и давления; в отличие от
значение константы KD зависит от свойств растворенного вещества, в частности от прочности связи между фрагментами молекул электролита, образующими катион и анион, от диэлектрич. свойств растворителя, его способности сольватировать ионы, а также от температуры и давления; в отличие от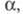 не зависит от концентрации раствора. Константа KD м. б. определена экспериментально, напр. по зависимости электропроводности раствора от концентрации электролита или путем прямого измерения содержания своб. ионов в растворе, напр., спектрофотометрич. методом.
не зависит от концентрации раствора. Константа KD м. б. определена экспериментально, напр. по зависимости электропроводности раствора от концентрации электролита или путем прямого измерения содержания своб. ионов в растворе, напр., спектрофотометрич. методом.
Соответственно понятиям полной и неполной Э.д. электролиты классифицируют на сильные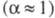 и слабые
и слабые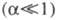 (см. электролиты), полностью диссоциируют в растворе многие соли неорг. кислот, некоторые кислоты и основания. Неполная Э.д. наблюдается для солей, катионы которых склонны к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Некоторые многоосновные кислоты, напр. H2SO4, полностью диссоциируют лишь в отношении отщепления одного иона H+, а дальнейшая диссоциация
(см. электролиты), полностью диссоциируют в растворе многие соли неорг. кислот, некоторые кислоты и основания. Неполная Э.д. наблюдается для солей, катионы которых склонны к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Некоторые многоосновные кислоты, напр. H2SO4, полностью диссоциируют лишь в отношении отщепления одного иона H+, а дальнейшая диссоциация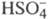 затруднена. Разб. растворы слабых электролитов по своим свойствам близки к идеальным растворам, для них в формуле (1) коэф. активности можно считать равными 1. Тогда формула (1) переходит в закон разведения Оствальда:
затруднена. Разб. растворы слабых электролитов по своим свойствам близки к идеальным растворам, для них в формуле (1) коэф. активности можно считать равными 1. Тогда формула (1) переходит в закон разведения Оствальда: 
в котором а можно заменить отношением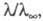 где
где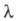 и
и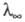 — соотв. эквивалентная электропроводность раствора при данной концентрации и при бесконечном разведении. В соответствии с законом Оствальда с уменьшением концентрации раствора степень диссоциации а и эквивалентная электропроводность возрастают, причем при бесконечном разведении
— соотв. эквивалентная электропроводность раствора при данной концентрации и при бесконечном разведении. В соответствии с законом Оствальда с уменьшением концентрации раствора степень диссоциации а и эквивалентная электропроводность возрастают, причем при бесконечном разведении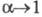 и
и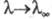 (см. электропроводность электролитов). Растворы сильных электролитов не являются идеальными и для их описания необходим учет межионного взаимод. даже в области предельного разведения. При определенных условиях, напр. в растворителях с малой диэлектрич. проницаемостью, при низких температурах или при образовании многовалентных ионов, благодаря сильному электростатич. притяжению противоположно заряженных ионов могут образовываться ионные ассоциаты, простейшими из которых являются ионные пары. Равновесие между сольватир. ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной — константой ассоциации. В приближении электростатич. взаимод. между ионами константа диссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, м. б. рассчитана по формуле:
(см. электропроводность электролитов). Растворы сильных электролитов не являются идеальными и для их описания необходим учет межионного взаимод. даже в области предельного разведения. При определенных условиях, напр. в растворителях с малой диэлектрич. проницаемостью, при низких температурах или при образовании многовалентных ионов, благодаря сильному электростатич. притяжению противоположно заряженных ионов могут образовываться ионные ассоциаты, простейшими из которых являются ионные пары. Равновесие между сольватир. ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной — константой ассоциации. В приближении электростатич. взаимод. между ионами константа диссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, м. б. рассчитана по формуле:
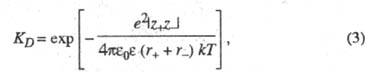
где е — элементарный электрич. заряд; k — постоянная Больцмана; 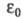 - электрич. постоянная (диэлектрич. проницаемость вакуума) ;
- электрич. постоянная (диэлектрич. проницаемость вакуума) ; 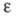 - диэлектрич. проницаемость растворителя; Т — абс. температура.
- диэлектрич. проницаемость растворителя; Т — абс. температура.
Понятие Э.д. было введено С. Аррениусом в 1887. Э.д. играет важную роль во мн. прир. и производств, процессах, определяя как свойства растворов электролитов, так и особенности происходящих в них процессов (см. реакции в растворах).
Лит.: Измайлов Н.А., Электрохимия растворов, 3 изд., М., 1976; Monk С. В., Electrolytic dissociation, L.-N. Y., 1961.
М. Ф. Головко
Значения в других словарях
- Электролитическая диссоциация — Распад вещества на ионы при растворении. Э. д. происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер (см. Сольватация). Большая советская энциклопедия
- ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — полный или частичный распад молекул растворенного вещества на ионы в результате взаимодействия с растворителем. Обусловливает ионную проводимость растворов электролитов. Большой энциклопедический словарь
- Электролитическая диссоциация — Или ионизация (литер. Svante Arrhenius, "Ueber die Dissociation der in Wasser gelösten Stoffe", "Zeitschr. für physikalische Chemie", 1887; Sv. Arrhenius, "La dissociation électrolytique des solutions. Rapport au Congrès internat. Энциклопедический словарь Брокгауза и Ефрона
