фосфор
ФОСФОР (от греч. phosphoros — светоносный; лат. Phosphorus) P
хим. элемент V гр. периодической системы; ат. номер 15, ат. м. 30,97376. Имеет один устойчивый нуклид 31P. Эффективное сечение захвата тепловых нейтронов 18∙10−30 м2. Конфигурация внеш. электронной оболочки атома 3s23p3; степени окисления −3, +3 и +5; энергия последоват. ионизации при переходе от Р° до P5+ (эВ): 10,486, 19,76, 30,163, 51,36, 65,02; сродство к электрону 0,6 эВ; электроотрицательность по По-лингу 2,10; атомный радиус 0,134 нм, ионные радиусы (в скобках указаны координац. числа) 0,186 нм для P3− , 0,044 нм (6) для P3+, 0,017 нм (4), 0,029 нм (5), 0,038 нм (6) для P5+.
Среднее содержание Ф. в земной коре 0,105% по массе, в воде морей и океанов 0,07 мг/л. Известно ок. 200 фосфорных минералов, все они представляют собой фосфаты. Из них важнейший — апатит, который является основой фосфоритов. Практич. значение имеют также монацит CePO4, ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe, Mn)PO4, торбернит Cu(UO2)2(PO4)2∙ 12H2O, отунит Ca(UO2)2(PO4)2 ∙ 10H2O, вивианит Fe3(PO4)2∙ 8H2O, пироморфит Pb5(PO4)3С1, бирюза CuAl6(PO4)4(OH)8∙ 5H2O.
Свойства. Известно св. 10 модификаций Ф., из них важнейшие — белый, красный и черный Ф. (техн. белый Ф. наз. желтым Ф.). Единой системы обозначений модификаций Ф. нет. Некоторые свойства важнейших модификаций сопоставлены в табл. Термодинамически устойчив при нормальных условиях кристаллич. черный Ф. (P I). Белый и красный Ф. мета-стабильны, но вследствие малой скорости превращения могут практически неограниченное время сохраняться при нормальных условиях.
СВОЙСТВА ВАЖНЕЙШИХ МОДИФИКАЦИЙ ФОСФОРА
таблица в процессе добавления
а Под давлением. б Температура кипения. 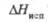
Белый Ф. (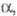 P III) образуется при конденсации паров и затвердевании расплава. Это белая прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные кристаллы, из-за высокой дисперсии света и большого показателя преломления похожие на алмазы. При −76,9 °C он превращается в
P III) образуется при конденсации паров и затвердевании расплава. Это белая прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные кристаллы, из-за высокой дисперсии света и большого показателя преломления похожие на алмазы. При −76,9 °C он превращается в 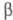 -модификацию белого Ф. (P IV) с плотн. 1,88 г/см3 с гексагон. [по др. данным, с ромбич. или кубич. (а = 0,734 нм)] кристаллической решеткой;
-модификацию белого Ф. (P IV) с плотн. 1,88 г/см3 с гексагон. [по др. данным, с ромбич. или кубич. (а = 0,734 нм)] кристаллической решеткой; 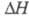 перехода
перехода 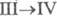 0,522 кДж/моль. В структуре белого Ф. содержатся тетраэд-рич. молекулы P4. В
0,522 кДж/моль. В структуре белого Ф. содержатся тетраэд-рич. молекулы P4. В 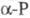 они могут свободно вращаться, в
они могут свободно вращаться, в 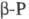 этого нет. Такие же молекулы наблюдаются в расплаве и парах Ф. Только выше ~ 800 °C начинается диссоциация на молекулы P2. При конденсации таких паров при −190 °C образуется неустойчивая модификация — коричневый Ф., состоящий, по-видимому, из молекул P2. Выше −100 °C он превращается в смесь белого и красного (P II) Ф.
этого нет. Такие же молекулы наблюдаются в расплаве и парах Ф. Только выше ~ 800 °C начинается диссоциация на молекулы P2. При конденсации таких паров при −190 °C образуется неустойчивая модификация — коричневый Ф., состоящий, по-видимому, из молекул P2. Выше −100 °C он превращается в смесь белого и красного (P II) Ф.
Зависимость давления пара белого Ф. от температуры: для твердого lg p (мм рт. ст.) = 19,0925 — 35291,4/Т- 3,5 lg T (273–317 К); для жидкого lg p (мм рт. ст.) = 4,512-2660/Т+1,243 lg T (317,3–530 К). Расплав белого Ф. очень легко переохлаждается. Плотн. расплава 1,749 г/см3.
Нагревание (без доступа воздуха) выше ~ 180 °C разрушает систему связей групп P4, в результате чего начинается полимеризация, приводящая к превращению в красный Ф. Описан целый ряд разновидностей красного Ф., различающихся по цвету — от оранжевого и ярко-красного до коричневого и черно-фиолетового, по плотности (2,0–2,4 г/см3), температуре плавления (585–610 °C) и т. п. При 250–300 °C образуется аморфный красный Ф. 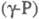 с плотн. 2,16 г/см3; при 360–450 °C — моноклинный красный Ф. (P П,
с плотн. 2,16 г/см3; при 360–450 °C — моноклинный красный Ф. (P П, 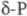 ); при ~ 500 °C — другая моноклинная модификация, также образующаяся при натр, белого Ф. с Pb или Bi (т. наз. Ф. Гитторфа, фиолетовый Ф.) с параметрами решетки а = 0,924 нм, в = 0,921 нм, с = 2,23 нм,
); при ~ 500 °C — другая моноклинная модификация, также образующаяся при натр, белого Ф. с Pb или Bi (т. наз. Ф. Гитторфа, фиолетовый Ф.) с параметрами решетки а = 0,924 нм, в = 0,921 нм, с = 2,23 нм, 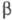 =107,4°. При длит. нагревании при ~ 600 °C образуется кубич. красный Ф. (пространств, группа РтЗт, а= 1,131 нм, z = 66, плотн. 2,35 г/см3). Описаны также трик-линный, тетрагон., гексагон. красный Ф. и др. Превращение Ф. белый
=107,4°. При длит. нагревании при ~ 600 °C образуется кубич. красный Ф. (пространств, группа РтЗт, а= 1,131 нм, z = 66, плотн. 2,35 г/см3). Описаны также трик-линный, тетрагон., гексагон. красный Ф. и др. Превращение Ф. белый  Ф. красный ускоряется при действии УФ облучения, а также в присутствии примесей I2, S, Se и т. д. В структуре красного Ф. существуют связанные между собой бесконечные цепи из тетраэдров P4. В этой структуре м. б. выделены группировки P8 и P9. При испарении и плавлении красного Ф. (при атм. давлении он сублимируется и м. б. расплавлен при давлении 4,5 МПа) образуются молекулы P4. Уравнение зависимости давления пара твердого красного Ф. от температуры: lgp (мм рт. ст.) = 14,207 — 6300/Т+ 3,298Т+ 0,156 lg Т (298- 866 К).
Ф. красный ускоряется при действии УФ облучения, а также в присутствии примесей I2, S, Se и т. д. В структуре красного Ф. существуют связанные между собой бесконечные цепи из тетраэдров P4. В этой структуре м. б. выделены группировки P8 и P9. При испарении и плавлении красного Ф. (при атм. давлении он сублимируется и м. б. расплавлен при давлении 4,5 МПа) образуются молекулы P4. Уравнение зависимости давления пара твердого красного Ф. от температуры: lgp (мм рт. ст.) = 14,207 — 6300/Т+ 3,298Т+ 0,156 lg Т (298- 866 К).
При давлении более 1,2 ГПа белый Ф. переходит в кристаллич. черный Ф. (P I, 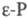 ). Для перехода красного Ф. требуется более высокое давление (2,5 ГПа), нагревание до ~ 200 °C облегчает переход. При меньших давлениях образуется аморфный черный Ф. (i-P) с плотн. 2,25 г/см3. Кристаллич. черный Ф. может быть получен и при атм. давлении — длит. нагреванием красного Ф. с ртутью при ~ 300 °C в присутствии затравки. Черный Ф. графитоподобный, его структура состоит из слабо связанных между собой гофрированных слоев. При атм. давлении черный Ф. возгоняется без плавления, уравнение зависимости давления пара от температуры lg ρ (мм рт. ст.) = 13,36-7560/Т. Плавится он при ~ 1000 °C под давлением 1,8 ГПа, экстраполяция на атм. давление дает т. пл. 606 °C. При натр, черный Ф. при давлении собств. паров при 560–580 С превращается в красный.
). Для перехода красного Ф. требуется более высокое давление (2,5 ГПа), нагревание до ~ 200 °C облегчает переход. При меньших давлениях образуется аморфный черный Ф. (i-P) с плотн. 2,25 г/см3. Кристаллич. черный Ф. может быть получен и при атм. давлении — длит. нагреванием красного Ф. с ртутью при ~ 300 °C в присутствии затравки. Черный Ф. графитоподобный, его структура состоит из слабо связанных между собой гофрированных слоев. При атм. давлении черный Ф. возгоняется без плавления, уравнение зависимости давления пара от температуры lg ρ (мм рт. ст.) = 13,36-7560/Т. Плавится он при ~ 1000 °C под давлением 1,8 ГПа, экстраполяция на атм. давление дает т. пл. 606 °C. При натр, черный Ф. при давлении собств. паров при 560–580 С превращается в красный.
При давлении 8,6 ГПа образуется Ф. V с ромбоэдрич. структурой типа 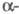 As с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а = 0,3524 нм, α=57,25°). При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а = 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на существование при высоких давлениях и др. модификаций Ф.
As с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а = 0,3524 нм, α=57,25°). При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а = 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на существование при высоких давлениях и др. модификаций Ф.
Белый и красный Ф. — диэлектрики, черный Ф. — полупроводник, модификации высокого давления, по-видимому, обладают металлич. свойствами. Сверхпроводимость наблюдается у модификаций P V и P VI ниже соотв. 4,7–6 К и 7,5–10 К (в зависимости от давления).
Белый Ф. очень активен. При переходе к красному и особенно черному Ф. хим. активность резко снижается. Белый Ф. на воздухе светится в темноте, с чем исторически связано его назв. (греч. phosphoros — светоносный). Свечение обусловлено окислением (с образованием низших оксидов) паров Ф- белый Ф. обладает заметной летучестью даже при низких температурах. Мелкодисперсный белый Ф. самовоспламеняется на воздухе, для компактного т. воспл. 34–50 °C. В воде он почти не раств. (3∙10−4% при 15 °C), очень хорошо раств. в CS2 (89,8% при 10 °C), раств. в PCl3, POCl3, жидких SO2, NH3, мало раств. в этаноле (0,31%), диэтиловом эфире (1,04%), бензоле (3,2%), CCl4 (1,27%), глицерине (0,17%), уксусной кислоте (~ 1%), ксилоле. Для красного и черного Ф. растворители не найдены.
Красный Ф. при комнатной температуре окисляется медленно, но некоторые его образцы могут самовоспламеняться из-за присут. следов белого Ф., а также наличия высокоактивного аморфного Ф. по границам зерен. T. воспл. красного Ф. 210 С (черного Ф. ок. 500 °C), но большие количества красного Ф. при длит. хранении на воздухе могут загораться из-за повышения температуры вследствие окисления.
При горении Ф. образуется оксид P4O10 (или P2O5, см. фосфора оксиды). С парами воды Ф. реагирует под давлением при 600–900 °C в присутствии катализаторов (Pt, Cu и др.) с вытеснением H2 и образованием H3PO4 (см. фосфорная кислота). Растворы неокисляющих минеральных кислот на Ф. не действуют, HNO3 окисляет его до H3PO4. При нагр. Ф. с растворами щелочей выделяется фосфин PH3. Белый Ф. реагирует с растворами солей электроположит. металлов (Cu, Pb, Ag и др.), вытесняя их из растворов с образованием фосфидов. Красный и черный Ф. этой способностью не обладают.
С водородом Ф. в обычных условиях не реагирует. Его гидриды (фосфины) получают косвенным путем. С фтором и белый и красный Ф. реагируют со взрывом. Белый Ф. воспламеняется в атмосфере хлора и паров брома, красный реагирует спокойно. Реакция с иодом у белого Ф. идет даже при охлаждении, тогда как у красного — при нагревании. Во всех случаях образуются разл. фосфора галогениды. При натр. Ф. в атмосфере галогеноводородов образуются фосфин и соли фосфония.
Пары Ф. реагируют с азотом в электрич. разряде или на накаленной вольфрамовой нити с образованием смеси аморфных нитридов P3N5 и PN. Обычно нитрид P3N5 (оранжево-коричневого цвета с плотн. 2,6 г/см3) получают взаимод. P4S10 с NH3 при нагревании. При его термич. разложении при ~ 800 °C м. б. получен полимерный низший нитрид PNx переменного состава (х = 0,7 до 1,19). Нитриды Ф. инертны, холодная вода на них не действует, они не разлагаются при нагр. в растворах HCl, разб. HNO3, растворах щелочей, не реагируют с хлором, на воздухе начинают окисляться выше 250 °C. Нитрид P3N5 используют как газопоглотитель в лампах накаливания и в галогенных лампах, для легирования кремния в технологии полупроводниковых материалов.
Белый Ф. при сплавлении с серой при температурах до ~ 100 °C образует систему эвтектич. типа с ограниченными твердыми растворами, выше ~ 230 °C компоненты реагируют с образованием серии сульфидов. Тетрафосфора трисульфид P4S3 — лимонно-желтые кристаллы ромбич. сингонии (а = 1,063 нм, .b — 0,969 нм, с = 1,372 нм, z = 8, пространственная группа РптЬ); т. пл. 172 °C, т. кип. 407 °C; плотн. 2,03 г/см3; С0р 162,6 Дж/(моль∙К); 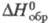 −130 кДж/моль;
−130 кДж/моль; 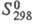 203,3 Дж/(моль∙К); т. воспл. 80–89 °C; горячей водой медленно разлагается; хорошо раств. в CS2 (50% при 17 °C), раств. в бензоле (2,5%), толуоле (3%); получают взаимод. желгого или красного Ф. и серы выше 250 °C в атмосфере CO2; очищают перегонкой или перекристаллизацией из CS2; компонент зажигат. смеси для спичечных коробок. Тетрафосфора декасульфид P4S10 (или P2S5, пентасульфид) — серовато-желтые кристаллы триклинной сингонии (а = 0,907 нм, b = 0,918 нм, с = 0,919 нм,
203,3 Дж/(моль∙К); т. воспл. 80–89 °C; горячей водой медленно разлагается; хорошо раств. в CS2 (50% при 17 °C), раств. в бензоле (2,5%), толуоле (3%); получают взаимод. желгого или красного Ф. и серы выше 250 °C в атмосфере CO2; очищают перегонкой или перекристаллизацией из CS2; компонент зажигат. смеси для спичечных коробок. Тетрафосфора декасульфид P4S10 (или P2S5, пентасульфид) — серовато-желтые кристаллы триклинной сингонии (а = 0,907 нм, b = 0,918 нм, с = 0,919 нм, 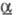 =92,4°,
=92,4°, 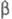 = 101,2°,
= 101,2°, 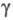 =110,5°, z = 2, пространственная группа Pl); т. пл. 288 °C, т. кип. 514 °C; плотн. 2,09 г/см3; C0p 296 Дж/(моль∙К);
=110,5°, z = 2, пространственная группа Pl); т. пл. 288 °C, т. кип. 514 °C; плотн. 2,09 г/см3; C0p 296 Дж/(моль∙К); 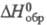 −364 кДж/моль; S0298 381,7 Дж/(моль∙К); гигроскопичен, разлагается горячей водой; мало раств. в CS2; реагирует со спиртами и др. орг. растворителями; получают аналогично P4S3; используют в синтезе флотореагентов, антикоррозионных добавок к смазочным маслам, инсектицидов и др. Известны также P4S5 и P4S7 и моносульфид PS (аморфный и кристаллический), а также селенид P4Se3 и теллурид Te3P2.
−364 кДж/моль; S0298 381,7 Дж/(моль∙К); гигроскопичен, разлагается горячей водой; мало раств. в CS2; реагирует со спиртами и др. орг. растворителями; получают аналогично P4S3; используют в синтезе флотореагентов, антикоррозионных добавок к смазочным маслам, инсектицидов и др. Известны также P4S5 и P4S7 и моносульфид PS (аморфный и кристаллический), а также селенид P4Se3 и теллурид Te3P2.
Пары Ф. реагируют с углеродом, только выше 2000 °C. Косвенным путем, напр. реакцией PCl3 с Mg2C2I2, можно получить карбид P2C6 — светло-желтая аморфная масса, не взаимод. с водой, растворами кислот и щелочей, но загорается на воздухе при самом слабом нагревании. С CO2 Ф. реагирует выше 650 °C с образованием CO и паров низших оксидов Ф. С CO не реагирует.
С кремнием пары Ф. взаимод. выше 1000 °C с образованием желто-коричневого силицида SiP, устойчивого до 1100 °C. Взаимод. гидридов PH3 и SiH4 получен Si2P голубовато-черного цвета. Силициды Ф. устойчивы на воздухе, гидролизу-ются горячей водой, разлагаются растворами щелочей, а также минеральных кислот при нагревании. С бором, а также со всеми металлами, кроме Sb и Bi, Ф. реагирует при нагр. с образованием фосфидов.
Ф. большей частью образует ковалентные связи как с одноименными атомами, так и с атомами др. элементов. Редкое исключение — частично ионные связи в некоторых фосфидах. Обычно наблюдаются простые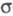 -связи. Часто образуются полимеры с такими связями (элементарный Ф., оксиды, полифосфаты и др.). Важнейшим соед. Ф. посвящены отдельные статьи (см. фосфора кислоты, фосфаты неорганические, фосфорорганические соединения и др.).
-связи. Часто образуются полимеры с такими связями (элементарный Ф., оксиды, полифосфаты и др.). Важнейшим соед. Ф. посвящены отдельные статьи (см. фосфора кислоты, фосфаты неорганические, фосфорорганические соединения и др.).
Получение. Ф. получают восстановлением фосфоритов или апатита коксом в присутствии SiO2 в электропечах при 1300–1500 °C по реакции:
4Ca5(PO4)3F + 21SiO2 + 30C 3P4 + 20CaSiO3 + SiF4 + З0СО
3P4 + 20CaSiO3 + SiF4 + З0СО
Образующиеся пары Ф. конденсируются на охлаждаемой поверхности в виде белого (желтого) Ф. и собираются под слоем нагретой воды (60 °C). В случае присутствия в шихте оксидов железа в качестве побочного продукта получается феррофосфор — сплав фосфидов Fe2P и Fe3P.
Красный Ф. получают нагреванием белого без доступа воздуха в течение неск. часов при 375–400 °C.
Очищают белый Ф. отстаиванием или фильтрованием расплава, переплавкой под слоем разб. хромовой смеси, обработкой 10–20%-ным раствором KOH при 90–100 °C, 50%-ной H2SO4 и деионизированной водой при 41–50 °C, сублимацией или перегонкой в вакууме либо перегонкой с водяным паром в атмосфере CO2, высокотемпературной обработкой паров (900–1200 °C) на кварцевой насадке, зонной плавкой. Кристаллы белого Ф. получают испарением растворителя из его растворов в CS2 или бензоле.
Красный Ф. очищают обработкой 3–5%-ными водными растворами минеральных кислот при 70 °C, кипячением с 7%-ным раствором щелочи, а затем кипячением с деионизированной водой. Ф. высокой чистоты получают гидридным методом — термич. разложением очищенного ректификацией фосфина.
Определение. Известные реакции обнаружения и определения Ф. в осн. относятся к ортофосфатным ионам. Для качеств, обнаружения преим. применяют реакцию образования при действии молибдата аммония в азотнокислой среде желтого осадка (или желтого окрашивания раствора) фосфоромолибдата аммония. Действие молибдата аммония в присутствии бензидина или некоторых др. восстановителей дает синее окрашивание (используют в виде капельной реакции на Ф.). Аналогичная реакция применяется для проявления пятен разл. фосфатов в бумажной хроматографии.
Наиб. употребительный гравиметрич. способ определения Ф. (если он находится в низших степенях окисления, его предварительно окисляют) — вышеуказанная реакция осаждения фосфоромолибдата аммония с послед. переосаждением в виде MgNH4PO4∙6H2O и прокаливанием осадка до Mg2P4O7 (весовая форма).
Титриметрич. фосфоромолибдатный метод заключается в осаждении фосфоромолибдата аммония, растворении осадка в титрованном растворе щелочи и титровании его избытка раствором кислоты. Близок к нему гидрооксихинолинмолибдатный метод — осаждение фосфоромолибдата 8-гидроксихинолином с послед, растворением в щелочи и кислотным титрованием. Известны методы прямого титрования фосфатов солями разл. металлов (Ag, Pb, Bi, Ce и др.), а также методы осаждения нерастворимых фосфатов (Ag, Bi и т. п.) с послед. титримет-рич. определением металлов.
Наиб. употребляемые фотометрич. методы определения Ф. основаны на реакции образования желтого фосфоромолибденового комплекса или его восстановленной формы синего цвета.
Применяют разл. физ. методы определения Ф.: спектральные, атомно-адсорбционный, люминесцентный, ЯМР, радио-активационный и др. Для отделения Ф. от др. элементов чаще всего используют экстракционные методы. Для разделения разл. фосфатных анионов обычно применяют бумажную хро-матографию.
Применение. Осн. долю всего добываемого Ф. (~ 90%) используют для получения P2O5 и т. наз. термической фосфорной кислоты, применяемой в производстве разл. фосфорных удобрений и разнообразных фосфатов, в т. ч. для животноводства (минеральных подкормок). Используют Ф. также для получения разнообразных фосфорсодержащих неорг. и орг. соединений. Белый Ф. применяют в качестве дымообразующего и зажигат. средства, для изготовления трассирующих боеприпасов.
Красный Ф. используют в спичечной промышленности как осн. компонент обмазки зажигат. поверхности спичечных коробков, как компонент термопластичных композиций, в производстве ламп накаливания — как газопоглотитель.
В металлургии Ф. применяют как раскислитель при получении некоторых сплавов, напр. хромаля, как легирующую добавку (фосфористый чугун содержит до 0,8% P, некоторые стали до 0,3% P, фосфористая бронза до 1,2% P), как компонент припоев и антифрикционных сплавов, магнитомягких сплавов, для фосфатирования поверхности стальных изделий с целью увеличения их коррозионной стойкости, для получения ферромагн. пленок в элементах памяти вычислит. машин. Ф. высокой чистоты используют для получения полупроводниковых фосфидов, в осн. типа АIПВ5.
Мировое производство Ф. (без стран СНГ) ок. 1 млн. т в год. Осн. производители — США, Германия, Нидерланды, Канада.
Белый Ф. очень ядовит — смертельная доза для человека 0,05–0,15 г. Симптомы острого отравления: желудочно-кишечные расстройства, сердечная недостаточность. При хро-нич. отравлении происходит изменение костей, в частности омертвение челюстей. Попадая на кожу, белый Ф. воспламеняется, давая тяжелые ожоги. ПДК в воздухе рабочей зоны 0,03 мг/м3. Хранят белый Ф. под слоем воды или незамерзающего раствора (CaCl2 или NaCl, ZnCl2) в темноте.
Красный Ф. менее токсичен, но его пыль может вызывать хронич. отравление, а также пневмонию, поражение кожи. T. к. красный Ф. может воспламеняться, в частности, при трений и ударе, разбивать его слитки рекомендуется орудиями из тефлона. Черный Ф. не токсичен, может обрабатываться без особых предосторожностей.
Ф. получил в 12 в. арабский алхимик Ахад Бехиль. В Европе Ф. впервые был получен Х. Брандом в 1669.
Лит.: Везер В.-Дж., Фосфор и его соединения, пер. с англ., М., 1962; Астахов К. В., Фосфор, М., 1972; Аналитическая химия фосфора, М., 1974; Ершов В. А., Технология производства фосфора, Л., 1978; Технология фосфора, Л., 1979; Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ., М., 1982; Миллер Т.Н., Витола А. А., Неорганические соединения фосфора с азотом, Рига, 1986; Физико-химические и технологические основы процесса получения красного фосфора, М., 1987.
П. И. Федоров
Значения в других словарях
- Фосфор — (лат. Phosphorus) Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376, неметалл. Природный... Большая советская энциклопедия
- фосфор — -а, м. Химический элемент, легко воспламеняющееся и светящееся в темноте вещество, содержащееся в некоторых минералах, в организме животных и растений. Белый фосфор. Красный фосфор. [От греч. φωσφόρος — светоносный] Малый академический словарь
- фосфор — орф. фосфор, -а Орфографический словарь Лопатина
- фосфор — Фо́сфор/. Морфемно-орфографический словарь
- фосфор — ФОСФОР а, м. phosphore m.<�гр. phos свет + phoros несущий. Распространенный химический элемент, играющий большую роль в жизнедеятельности животных и растений. Белый, красный, черный фосфор. БАС-1. Бывают натуральные и произведенные искусством фосфоры. Словарь галлицизмов русского языка
- фосфор — ФОСФОР (Phosphorus) , P, хим. элемент V гр. периодич. системы Менделеева. Ср. содержание Ф. в земной коре 9,3·10–2% (по массе). Ок. 180 минералов, наиб. практически важны фосфориты и апатиты. В почвах Ф. ок. 0,1 — 0,2% (5 — 25 т/га), ок. Сельскохозяйственный словарь
- Фосфор — • Phosphŏrus, Φωσφόρος, Φαεσφόρος, Έωσφόρος, Lucifer, Eous светоноситель 1. звезда Венера как денница. Ноm. Il. 23, 226. Verg. Georg. 1, 228. Ov. met. 2, 115. Как вечерняя звезда он называется Геспером. Vesper, Vesperugo, Noctifer, Nocturnus. Ноm. Il. Словарь классических древностей
- фосфор — Заимств. в XVIII в. из языка ученой латыни, где оно восходит к греч. phōsphoros «светоносный». Вещество названо по его свойству светиться за счет ранее поглощенной энергии. Этимологический словарь Шанского
- ФОСФОР — ФОСФОР (символ Р), химический элемент пятой группы периодической таблицы, впервые обнаруженный в 1669 году. Встречается в виде ФОСФАТОВ в минералах, главный источник фосфора — АПАТИТ. Научно-технический словарь
- Фосфор — I Фосфор (Phosphorus, Р) химический элемент главной подгруппы V группы периодической системы элементов Д.И. Менделеева. Элементарный Ф. известен в нескольких аллотропных модификациях: белый (желтый), красный и черный Ф. Многие соединения Ф. токсичны (см. Медицинская энциклопедия
- Фосфор — P (лат. Phosphorus * a. phosphorus; н. Phosphor; ф. phosphore; и. fosforo), — хим. элемент V группы периодич. системы Mенделеева, ат.н. 15, ат. м. 30,97376. Природный Ф. представлен одним стабильным изотопом 31P. Известно 6 искусств. Горная энциклопедия
- фосфор — ФОСФОР, а, м. Химический элемент, содержащийся в нек-рых минералах, в костях животных, в животных и растительных тканях. Красный ф. Белый ф. (легковоспламеняющийся и светящийся в темноте). | прил. фосфорный, ая, ое. Толковый словарь Ожегова
- фосфор — Ф’ОСФОР, фосфора, мн. нет, ·муж. (·греч. phosphoros — светоносный) (·хим. ). Химический элемент, легко воспламеняющееся и светящееся в темноте вещество, находящееся в составе некоторых минералов, в костях животных, в животных и растительных тканях. Толковый словарь Ушакова
- фосфор — ФОСФОР -а; м. [от греч. phōsphoros — светоносный] Химический элемент (P), играющий важную роль в жизнедеятельности животных и растений (содержится в некоторых минералах, в костях животных, в животных и растительных тканях). Красный ф. Чёрный... Толковый словарь Кузнецова
- фосфор — ФОСФОР м. химически добываемое, простое (несложное) вещество, самосветное, крайне горючее. Фосфорные спички; — кислота, 4-я степень окисленья. Фосфористый запах; — кислота, 3-я степень. Толковый словарь Даля
- фосфор — Фосфора, мн. нет, м. [греч. phosphoros – светоносный] (хим.). Химический элемент, легко воспламеняющееся и светящееся в темноте вещество, находящееся в составе нек-рых минералов, в костях животных, в животных и растительных тканях. Большой словарь иностранных слов
- ФОСФОР — ФОСФОР (греч. светоносный) — в греческой мифологии божество утренней зари, одно из прозвищ Венеры. В римской мифологии — Люцифер. ФОСФОР (лат. Большой энциклопедический словарь
- фосфор — фосфор м. Легко воспламеняющееся и светящееся в темноте вещество, содержащееся в некоторых минералах и играющее важную роль в жизнедеятельности животных и растений; химический элемент. Толковый словарь Ефремовой
