фосфора галогениды
ФОСФОРА ГАЛОГЕНИДЫ
тригалогениды PX3, пентагалогениды PX5 (X = F, Cl, Br), смешанные галогениды, напр. PClF2, PCl2F3, окси- POX3 и тиогалогениды PSX3, низшие галогениды — галогениды P(II), напр. P2Cl4, P2I4. Свойства Ф. г. приведены в табл. PCl3, PBr3, POCl3, PSCl3, P2Cl4 — бесцв. жидкости; PI3 — красные кристаллы гексаген, сингонии; PCl5 — бесцв. зеленоватые кристаллы тетрагон. сингонии; POBr3 — бесцветные кристаллы; PBr5 — красновато-желтые кристаллы ром-бич, сингонии; P2I4 — оранжевые кристаллы триклинной сингонии, т. пл. 126,1 °C, плотн. 4,18 г/см3; остальные — бесцв. газы. Молекулы Ф. г. сравнительно малополярны.
СВОЙСТВА НЕКОТОРЫХ ГАЛОГЕНИДОВ ФОСФОРА
таблица в процессе добавления
а Для газа. б Для жидкости. в Для кристаллов.г Температура возгонки.д Относительно воздуха.
Молекулы PX3 имеют конфигурацию тритон, пирамиды с атомом P в вершине. Длина связи P — X меняется от 0,155 нм для PF3 до 0,255 нм для PI3, угол XPX ~ 100°. Полярность молекул падает при переходе от PF3 к PI3, температура плавления растет в результате увеличения межмол. взаимодействия. Трихлорид PCl3 дымит во влажном воздухе (из-за гидролиза с выделением HCl), энергично взаимод. с водой, образуя фосфористую и соляную кислоты. Хорошо раств. в диэтиловом эфире, бензоле, CHCl3, CS2, CCl4. Получают пропусканием Cl2 в раствор белого P в CS2 или сжиганием P в атмосфере сухого Cl2. Применяют для получения PCl5, POCl3, PSCl3, фосфор-орг. соед., в производстве красителей, лекарственных средств, инсектицидов (эфиры тиофосфорных кислот) и ПАВ. Токсичен, ПДК 0,2 Мг/м3.
Молекулы пентахлорида PCl5, находящегося в жидком или газообразном состоянии, имеют конфигурацию три-гон. бипирамиды с атомом P в основании. Расстояния Cl-Cl в основании бипирамиды 0,308 нм, длина экваториальной связи P-Cl 0,21 нм, апикальной — 0,225 нм. Твердый PCl5 построен из тетраэдрич. ионов 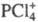 и октаэдрических
и октаэдрических 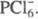 Длина связей P — Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В парах выше 300 °C полностью разлагается на PCl3 и Cl2, DH реакции 129,7 кДж/моль. Гидролизуется водой сначала до POCl3, затем до H3PO4. Лучший растворитель для PCl5- CCl4, раств. также в CS2. При взаимодействии PCl5 с NH4Cl получается фосфонитрил-хлорид PNCl2, образующий при 120–150 °C циклич. тример, который выше 300 °C дает неорг. полимер (Cl2P = N)n (см. полифосфазены). Получают PCl5 взаимод. PCl3 с избытком Cl2, а также пропусканием Cl2 в раствор PCl3 в CS2. PCl5 — хлорирующий агент, его используют при получении хлоран-гидридов фосфорных кислот, фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей. Токсичен, ПДК 0,2 мг/м3.
Длина связей P — Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В парах выше 300 °C полностью разлагается на PCl3 и Cl2, DH реакции 129,7 кДж/моль. Гидролизуется водой сначала до POCl3, затем до H3PO4. Лучший растворитель для PCl5- CCl4, раств. также в CS2. При взаимодействии PCl5 с NH4Cl получается фосфонитрил-хлорид PNCl2, образующий при 120–150 °C циклич. тример, который выше 300 °C дает неорг. полимер (Cl2P = N)n (см. полифосфазены). Получают PCl5 взаимод. PCl3 с избытком Cl2, а также пропусканием Cl2 в раствор PCl3 в CS2. PCl5 — хлорирующий агент, его используют при получении хлоран-гидридов фосфорных кислот, фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей. Токсичен, ПДК 0,2 мг/м3.
Молекула оксихлорида POCl3 имеет форму искаженного тетраэдра с атомом P в центре; μ 8,01∙10−30 Кл∙м.. Полярный растворитель, подвергается самоионизации (POCl3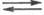 POCl+2+ С1−), раств. неорг. соли, напр. NaCl, NH4Cl. Хорошо раств. в бензоле, CHCl3, CCl4, CS2. Сильно дымит во влажном воздухе, гидролизуется водой до H3PO4. Получают пропусканием O2 через PCl3 при 20–50 °C, взаимод. PCl5 с P2O5 или H2C2O4. Применяют для получения инсектицидов, орг. фосфатов H3PO4, в частности трибутилфосфата. Токсичен, ПДК в воздухе рабочей зоны 0,05 мг/м3.
POCl+2+ С1−), раств. неорг. соли, напр. NaCl, NH4Cl. Хорошо раств. в бензоле, CHCl3, CCl4, CS2. Сильно дымит во влажном воздухе, гидролизуется водой до H3PO4. Получают пропусканием O2 через PCl3 при 20–50 °C, взаимод. PCl5 с P2O5 или H2C2O4. Применяют для получения инсектицидов, орг. фосфатов H3PO4, в частности трибутилфосфата. Токсичен, ПДК в воздухе рабочей зоны 0,05 мг/м3.
Тиохлорид PSCl3 по свойствам близок к POCl3; получают взаимод. S с PCl3 в автоклаве в присутствии AlCl3. Используют в производстве инсектицидов (эфиры тиофосфорных кислот).
Фториды и бромиды P получают из простых веществ, PF5 применяют в производстве фторофосфатов, как ингибитор коррозии металлов в среде N2O4.
Лит.: Везер В.-Дж., Фосфор и его соединения, пер. с англ., М., 1962; Угай Я. А., Неорганическая химия, М., 1989.
Я. А. Угай
Значения в других словарях
- Фосфора галогениды — Соединения фосфора с галогенами, из которых важны и хорошо изучены тригалогениды PX3 (где Х – галоген): PF3, PCl3, PBr3; пентагалогениды PX5: PF5, PCl5, PBr5. Большая советская энциклопедия
