координационная связь
КООРДИНАЦИОННАЯ СВЯЗЬ
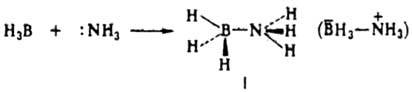
хим. связь в комплексных соединениях, в которых один или неск. атомов образуют большее число связей, чем допускает высшая формальная валентность этих атомов. Различают двухцентровые (донорно-акцепторные) и многоцентровые К. с. К первым относят связи, образование которых (формирование заполненной двумя электронами связывающей двухцентровой мол. орбитали) можно описать как передачу электронной пары, локализованной на одном из атомных центров лиганда (донора), на своб. орбиталь атома-комплексообразователя (акцептора). Такие К. с. способны образовывать атомы как непереходных, так и переходных элементов, но более характерны они для последних, т. к. их вакантные d- и f-орбитали имеют низко расположенные энергетич. уровни, что облегчает акцептирование электронных пар с валентных орбиталей лиганда. Примеры двухцентровых К. с. — связи В—N в боразане (формула I), связи Fe—С, Ti—О, Со—N в комплексных ионах
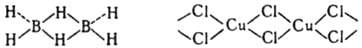
[Fe(CN)6]4−, [Ti(H2O)6]3+, [Co(NH3)6]3+. Природа таких связей не отличается от природы обычной полярной ковалентной связи (см. химическая связь). Различны лишь способы их образования. В случае К. с. электронная пара связи поставляется одним из взаимодействующих центров (лигандом). Ковалентная связь формируется валентными электронами обоих взаимодействующих центров. Однотипность этих видов хим. связи наглядно проявляется, напр., в том, что образование новой связи N—Н в ионе аммония NH4+ при протонировании аммиака можно рассматривать как возникновение К. с. К координационным должны быть причислены и т. наз. семиполярные связи типа 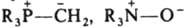 , образование которых обычно описывают как предварит. перенос одного электрона от донора к акцептору с послед. спариванием неподеленных электронов и формированием общей связывающей орбитали. Частный случай К. с. — водородная связь. В случае многоцентровой К. с. результирующая мол. орбиталь делокализована. Примеры многоцентровых К. с. — трехцентровые мостиковые связи В—Н—В в боранах, М—Cl—М в кристаллах и ассоциатах галогенидов металлов:
, образование которых обычно описывают как предварит. перенос одного электрона от донора к акцептору с послед. спариванием неподеленных электронов и формированием общей связывающей орбитали. Частный случай К. с. — водородная связь. В случае многоцентровой К. с. результирующая мол. орбиталь делокализована. Примеры многоцентровых К. с. — трехцентровые мостиковые связи В—Н—В в боранах, М—Cl—М в кристаллах и ассоциатах галогенидов металлов:
Особенно важное значение имеют многоцентровые К. с., образуемые лигандами с сопряженными системами π-связей. Координационные соед. с К. с. данного типа относят к я-комплексам. Отличит, особенность этих соед.: связь атома-комплексообразователя с лигандом осуществляется не с одним, а сразу с неск. атомными центрами. Примеры π-комплексов — ферроцен (формула II), η1, η5-бис-(циклопентадиенил)железодикарбонил (III).
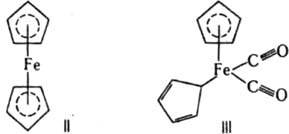
При образовании К. с. с лигандами, имеющими энергетически низко расположенные вакантные π-орбитали (СО, CN−, некоторые циклы с сопряженными связями), важную роль играют дополнит. донорно-акцепторные связи π-типа (см. кратные связи), в которых π-орбитали лиганда заселяются электронной парой с π-орбитали центр, атома — т. наз. дативные связи. Такие связи 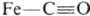 реализуются в комплексе формулы III. Образование К. с. при координации сопряженных соед. на атоме металла ведет к значит. поляризации связей лиганда и их активации по отношению к нуклеоф. агентам. Этим определяется существо металлокомплексного катализа, позволяющего резко повысить реакционная способность мало реакционноспособных олефинов, связей C—H и др. Во многих орг. реакциях промежут. образование соединений с К. с., напр. π-комплекса (IV) при электроф. присоединении, также является важной стадией механизма реакции:
реализуются в комплексе формулы III. Образование К. с. при координации сопряженных соед. на атоме металла ведет к значит. поляризации связей лиганда и их активации по отношению к нуклеоф. агентам. Этим определяется существо металлокомплексного катализа, позволяющего резко повысить реакционная способность мало реакционноспособных олефинов, связей C—H и др. Во многих орг. реакциях промежут. образование соединений с К. с., напр. π-комплекса (IV) при электроф. присоединении, также является важной стадией механизма реакции:
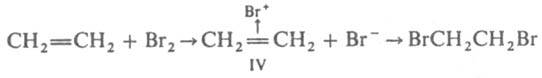
Многообразие типов К. с. обусловливает разнообразие структурных типов молекул координационных соед., а также кристаллич. структур твердых тел. Лучший способ описания К. с. и строения координационных соед. — метод мол. орбиталей. Однако полные расчеты таких соед. сопряжены нередко с большими вычислит. трудностями. Поэтому для объяснения и предсказания свойств координационных соед. во многих случаях целесообразно использовать методы, основанные на более простых физ. моделях. К последним относятся теории кристаллич. поля и поля лигандов.
Лит.: Минкин В. И., Симкин Б. Я., Миняев Р. М., Теория строения молекул, М., 1979; Берсукер И. Б., Электронное строение и свойства координационных соединений, 3 изд., Л., 1986.
В. И. Минкин
Значения в других словарях
- КООРДИНАЦИОННАЯ СВЯЗЬ — То же, что (см. ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ). Физический энциклопедический словарь
- КООРДИНАЦИОННАЯ СВЯЗЬ — КООРДИНАЦИОННАЯ СВЯЗЬ (донорно-акцепторная связь) — вид химической связи; характерна для комплексных соединений... Большой энциклопедический словарь
