кратные связи
КРАТНЫЕ СВЯЗИ
хим. связи двухцентрового типа, которые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих К. с., различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов К. с. сопоставляются с мол. орбиталями, которые по свойствам симметрии делят на σ-, π- и d-орбитали. π-Орбитали антисимметричны относительно плоскости, проходящей через связь. В многоатомных молекулах эта плоскость является общей для всей молекулы или для мол. фрагмента, включающего эту связь. d-Орбитали антисимметричны относительно двух взаимно перпендикулярных плоскостей, проходящих через связь. При образовании К. с. возникает, как правило, одна (или более) σ-орбиталь и обязательно хотя бы одна π- или d-орбиталь. По этой причине составляющие К. с., определяемые π- или d-орбиталями, наз. соотв. π- или d-связями. Атомы непереходных элементов в молекулах и ионах м. б. связаны простой, двойной и тройной связями. Образование простой d-связи C—C в молекуле этана соотносят с перекрыванием двух sp3-гибридных орбиталей атомов углерода. В молекуле этилена кроме σ-связи C—C присутствует одна, а в молекуле ацетилена с тройной связью — две π-связи:
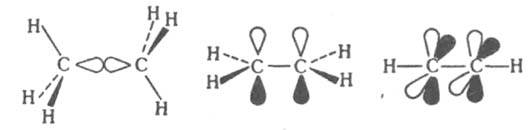
Четверная связь (и м. б. связи более высокой кратности) характерна только для переходных металлов. d-Перскрываниe ведет к образованию четверных связей в солях октагалогеиодиренат-аниона Re2Hal82−, карбоксилатах молибдена и вольфрама M(OOCR)4, внутрикомплексных соед. хрома и ванадия М2А2, где А — 2,6-диметоксифенил. Энергетич. вклады, приходящиеся на связи разл. типов, неравноценны. Обычно энергия π-связи составляет в среднем около 80% энергии σ-связи, а вклад d-связи оценивается, напр., в солях октахлородирснат-аниона всего в 14% от полной энергии связи. Чем выше кратность связи, тем больше ее прочность (энергия диссоциации), короче межатомное расстояние и больше силовая постоянная связи (см. табл.).

Две или больше К. с. могут образовывать в хим. соединении системы кумулированных и сопряженных связей. В первом случае две двойные связи примыкают к одному и тому же атому как, напр., в аллене H2C=C=CH2; во втором — двойные или (и) тройные связи разделены одной простой, как, напр., в 1,3-бутадиене H2C=CН—CH=CH2 или акрилонитриле 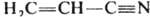 . В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет которой осуществляется обычно при помощи методов квантовой химии.
. В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет которой осуществляется обычно при помощи методов квантовой химии.
Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975; Коттон Ф. А., Уолтон Р., Кратные связи металл — металл, пер. с англ., М., 1985.
В. И. Минкин
Значения в других словарях
- Кратные связи — Тип химической связи, осуществляемой двумя или тремя парами электронов, общими для двух непосредственно соединённых атомов, как, например, в этилене H2C = CH2, формальдегиде H2C = О, ацетилене HC ≡ CH, синильной кислоте Н—С ≡ N (подробнее см. Двойная связь. Тройная связь). Большая советская энциклопедия
