ингибиторы
ИНГИБИТОРЫ (от лат. mhibeo — останавливаю, сдерживаю)
вещества, тормозящие хим. реакции. Ингибирование характерно для каталитич и цепных реакций, которые протекают с участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что И. блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. И. вводится в систему в концентрации много меньшей, чем концентрации реагирующих веществ (10−2–10−5 моль%). Кинетика реакций с участием И. принципиально различна для каталитических и цепных реакций. В каталитич. реакции число активных центров фиксировано и И., блокируя часть из них, не расходуется в ходе процесса. Поэтому при введении И. скорость реакции снижается, а затем процесс протекает длит. время с постоянной скоростью. В некоторых случаях эта скорость может медленно возрастать из-за расходования И. по к.-л. побочной реакции. В цепной реакции активные частицы непрерывно генерируются, что приводит к расходованию И. и постепенному самоускорению реакции (в случае цепной неразветвленной реакции обычно восстанавливается исходная скорость).
Ингибирование цепных реакций. Длительность t тормозящего действия И. наз. периодом индукции; число цепей f, которые обрывает одна молекула И., последовательно вступая в реакции обрыва, наз. стехиометрич. коэф. ингибирования. При исходной концентрации И. [И]0 и скорости инициирования цепей vi период индукции равен: t = f [И]0/vi. Например, хинон тормозит полимеризацию виниловых мономеров, вступая в след. реакции:
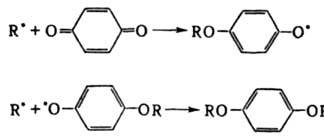
В этом случае f= 2 и t = 2[И]0/vi. В некоторых системах происходит регенерация И. в реакциях обрыва цепи, в результате чего одна молекула И. и образующийся из нее радикал многократно участвуют в реакциях обрыва. Например, при введении ионов меди в окисляющийся изопропиловый спирт цепи обрываются в результате протекания след. чередующихся реакций:
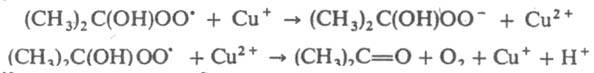
В таких системах наблюдаются периоды индукции, намного превышающие 2[И]0/vi. Для каждой реакции существует специфич. набор И.: реакцию водорода с хлором тормозят NCl3 и O2, реагирующие с атомами хлора; полимеризацию виниловых мономеров — хиноны, нитросоединения, I2, стабильные радикалы (дифенилпикрилгидразил, нитроксильные радикалы), акцептирующие алкильные макрорадикалы; окисление орг соед. (углеводородов, каучуков и полиолефинов) фенолы, ароматич. амины, аминофенолы, реагирующие с пероксильными радикалами RO2; крекинг углеводородов олефины и оксиды азота, реагирующие с алкильными радикалами. Для тушения горения орг соед. используют галогенуглеводороды CF3Br, CF2ClBr, C2F4Br2. Их ингибирующее действие вызвано тем, что разветвляющими агентами при горении являются атомы Н, с которыми И. вступают в реакцию: RBr + 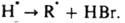 Образующийся HBr вызывает дополнит. обрыв цепей по реакциям:
Образующийся HBr вызывает дополнит. обрыв цепей по реакциям:
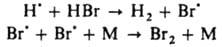
(М — любая третья частица). Для тушения горения применяют также огнегасящие порошки (напр.. NaHCO3, фосфорно-аммониевые соли), которые обладают комбинир. действием: снижают концентрацию радикалов из-за интенсивного обрыва цепей на поверхности и вызывают повыш. теплоотвод (см. горение). Различают слабые и сильные И. данной реакции. Сильным считается такой И., который, если его ввести в достаточно большой концентрации, сокращает длину цепи до единицы или уменьшает скорость реакции в v0/vi раз, где v0 — исходная скорость реакции. Слабый И., даже введенный в сравнительно высокой концентрации, снижает скорость реакции от vi до некоторого значения v > vi. Вызвано это тем, что из молекул слабого И. образуются радикалы, способные продолжать цепь, в силу чего отношение v0/v уменьшается с увеличением [И]0, не достигнув значения v0/vi. И., оказывающий сильное тормозящее действие в небольшой концентрации, наз. эффективным. Эффективность И. характеризуют значением производной —dv/d[И]. Например, окисление углеводорода RH в присутствии инициатора, создающего скорость инициирования vi, определяется скоростью продолжения цепи с участием пероксильного радикала:
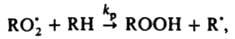
так что начальная скорость цепного окисления v = kp. [RH] [ ]. В присут. И., напр., фенола, цепи обрываются по реакции типа
]. В присут. И., напр., фенола, цепи обрываются по реакции типа 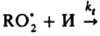 продукты. В квазистационарных условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [
продукты. В квазистационарных условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [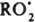 ] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp. Для ингибирования цепных разветвленных реакций характерны критич. явления, сущность которых состоит в резком снижении скорости реакции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в котором осн. источником радикалов является продукт окисления ROOH. При достаточно высокой температуре или в присутствии катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует некоторая критич. концентрация И., при которой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1–1%) изменении концентрации И. Это выражается в резком изменении скорости реакции или периода индукции И. Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 — длительности тормозящего действия первого и второго И., введенных порознь, а t12 — длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t — концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp. Для ингибирования цепных разветвленных реакций характерны критич. явления, сущность которых состоит в резком снижении скорости реакции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в котором осн. источником радикалов является продукт окисления ROOH. При достаточно высокой температуре или в присутствии катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует некоторая критич. концентрация И., при которой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1–1%) изменении концентрации И. Это выражается в резком изменении скорости реакции или периода индукции И. Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 — длительности тормозящего действия первого и второго И., введенных порознь, а t12 — длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t — концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
Ингибирование гетерогенно-каталитических реакций осуществляется веществами, которые наз. ядами каталитическими. Торможение реакции обусловлено снижением активности катализатора вследствие адсорбции И. на его поверхности.
Ингибирование ферментативных реакций м. б. обратимым и необратимым. В обоих случаях И. способен к образованию комплекса с ферментом, но не м. б. подвергнут каталитич. превращению и препятствует образованию комплекса фермент — субстрат. Например, бутанол ингибирует гидролиз сложных эфиров, катализированный карбоксипептидазой. Различают след. случаи обратимого ингибирования. Прямое конкурентное ингибирование, при котором молекулы И. I и субстрата S конкурируют за присоединение к активному центру фермента Е. Процесс описывается соотношениями (Р — продукт превращения):
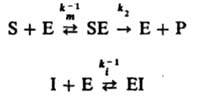
При таком механизме торможения, если [Е] << [S]0 и Е << [I]0, начальная скорость превращ. субстрата S равна:
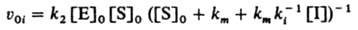
Неконкурентное ингибирование, при котором И. присоединяется к активному ферменту или комплексу фермента с субстратом с образованием каталитически неактивной формы:
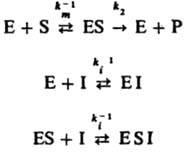
В этом случае начальная скорость реакции равна:
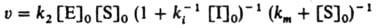
Внеконкурентное ингибирование, при котором И. образует каталитически неактивный комплекс с субстратом:
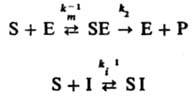
Начальная скорость реакции равна:
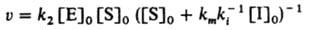
Отмечены случаи ингибирования фермента субстратом, когда неактивный комплекс с ферментом образует вторая молекула субстрата (субстратное ингибирование). Необратимо реагирующие И. реагируют с ферментом, дезактивируя его; в отличие от обратимого ингибирования активность фермента уменьшается во времени.
Применение. Ингибирование широко используется для регулирования скорости радикальной полимеризации, в частности при получении изделий большого объема. И. окисления используют для стабилизации полиолефинов и каучуков при их переработке и в условиях эксплуатации (см. деструкция полимеров), для стабилизации смазочных материалов и углеводородных топлив, сохранения пищ. жиров и лек. препаратов; в технологии получения мономеров они используются для предотвращения окислит. полимеризации. В исследовательских работах И. применяются для изучения механизма цепных реакций, в частности определения скорости инициирования.
Лит.: Ашмор П., Катализ и ингибирование химических реакций, пер. с англ., М., 1966; Уэбб Л., Ингибиторы ферментов и метаболизма, пер. с англ., М., 1966; Кулиев А. М., Химия и технология присадок к маслам и топливам, М., 1972; Денисов Е.Т., Ковалев Г. И., Окисление и стабилизация реактивных топлив, М., 1983.
Е. Т. Денисов
Значения в других словарях
- ингибиторы — Хим. вещества, снижающие скорость биохим. реакций или подавляющие их путем воздействия на соответствующие ферменты. И. используют в качестве лекарственных средств (напр., сульфамиды), пестицидов, а также при изучении метаболизма живых организмов (анализ ингибиторный). Микробиология. Словарь терминов
- ингибиторы — Ингибиторы — вещества, блокирующие те или иные звенья метаболизма живого организма, тем самым подавляя его развитие. Толковый словарь по почвоведению
- Ингибиторы — I Ингиби́торы (от лат. inhibeo — останавливаю, сдерживаю) в биологии, природные и синтетические вещества, угнетающие активность ферментов (как в живом организме, так и в бесклеточных системах); различаются по характеру действия, специфичности и др. Большая советская энциклопедия
- ингибиторы — (от лат. inhibeo — сдерживаю, останавливаю), вещества разл. химич. природы, подавляющие каталитич. активность отд. ферментов или ферментных систем. Наряду с репрессорами синтеза ферментов... Биологический энциклопедический словарь
- ингибиторы — (ИНГИБИРУЮЩИЕ ВЕЩЕСТВА). Собирательное наименование химических веществ и соединений... Кулинарный словарь
- ингибиторы — ингибиторы мн. 1. Вещества, замедляющие протекание химических реакций (вплоть до полного их прекращения). 2. Вещества, подавляющие активность ферментов. 3. Противогипертонические лекарственные средства, позволяющие выравнивать кровяное давление, не допуская его резких скачков. Толковый словарь Ефремовой
- ИНГИБИТОРЫ — ИНГИБИТОРЫ (от лат. inhibeo — удерживаю) — вещества, снижающие скорость химических, в т. ч. ферментативных, реакций или подавляющие их. Большой энциклопедический словарь
