горение
ГОРЕНИЕ
физ.-хим. процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло- и массообменом с окружающей средой. В отличие от взрыва и детонации протекает с более низкими скоростями и не связано с образованием ударной волны. В основе Г. лежит химическая реакция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла (тепловое Г.) или активных промежут. продуктов (цепное Г.). наиб. распространено тепловое Г.; цепное Г. в чистом виде встречается сравнительно редко, гл. обр. в случае некоторых газофазных реакций при низких давлениях.
Условия термич. самоускорения м. б. обеспечены для всех реакций с достаточно большими тепловыми эффектами и энергиями активации. Наиб. обширный класс реакций Г. — окисление углеводородов, напр. при Г. прир. топлив, водорода, металлов и т. п.; окислители-кислород, галогены, нитросоединения, перхлораты. В режиме Г. могут происходить: разложение озона, ацетилена, гидразина, динитрогликоля, метилнитрата и др.; окислительно-восстановит. реакции, в которых восстановители-элементы с высоким сродством к кислороду (Са, Al, Si, Mg и др.); синтез из элементов оксидов, галогенидов, халькогенидов, гидридов, интерметаллидов, тугоплавких нитридов и карбидов.
Г. может начаться самопроизвольно в результате самовоспламенения либо быть инициированным зажиганием (см. воспламенение). При фиксиров. внеш. условиях (давление, температура, размеры реактора, параметры тепло- и массопереноса и др.) непрерывное Г. может протекать в стационарном режиме, когда осн. характеристики процесса — скорость реакции, количество тепла, выделяющегося в единицу времени (мощность тепловыделения), температура и состав продуктов — не изменяются во времени, либо в периодич. режиме, когда эти характеристики колеблются около своих средних значений. Вследствие сильной нелинейной зависимости скорости реакции от температуры Г. отличается высокой чувствительностью к внеш. условиям: при их незначит. изменении медленная реакция может перейти в режим Г. или, наоборот, развитое Г. может прекратиться. Это же свойство Г. обусловливает существование неск. стационарных режимов при одних и тех же условиях (гистерезисный эффект).
Теория горения.
При адиабатич. сжигании горючей смеси, т. е. в отсутствие теплообмена между реагирующей системой и окружающей средой, м. б. рассчитаны количество выделившегося при Г. тепла, температура ТГ, которая была бы достигнута при полном сгорании (т. наз. адиабатич. температура Г.), и состав продуктов, если известны состав исходной смеси и термодинамич. функции исходной смеси и продуктов. Если состав продуктов заранее известен, ТГ м. б. рассчитана из условия равенства внутр. энергии системы (при пост. объеме) или ее энтальпии (при пост. давлении) в исходном и конечном состояниях с помощью соотношения: ТГ = Т0 + Qr/C, где Т0-начальная температура смеси, С-средняя в интервале температур от Т0 до ТГ уд. теплоемкость исходной смеси (с учетом ее изменения при возможных фазовых переходах), (QГ-УД- теплота сгорания смеси при температуре ТГ. При относительном содержании а0 в смеси компоненты, полностью расходуемой в реакции (напр., горючего), QГ = Q*а0 где Q-тепловой эффект реакции Г. Значение Тр при пост, объеме больше, чем при пост. давлении, поскольку в последнем случае часть внутр. энергии системы расходуется на работу расширения. На практике условия адиабатич. Г. обеспечиваются в тех случаях, когда реакция успевает завершиться прежде, чем станет существенным теплообмен между реакц. объемом и окружающей средой, напр. в камерах сгорания крупных реактивных двигателей, в больших реакторах, при быстро распространяющихся волнах горения.
Термодинамич. расчет дает лишь частичную информацию о процессе — равновесный состав и температуру продуктов. Полное описание Г., включающее также определение скорости процесса и критич. условий при наличии тепло- и массообмена с окружающей средой, можно провести только в рамках макрокинетич. подхода, рассматривающего химическую реакцию во взаимосвязи с процессами переноса энергии и вещества (см. макрокинетика). В случае заранее перемешанной смеси горючего и окислителя реакция Г. может происходить во всем пространстве, занятом горючей смесью (объемное Г.), или в сравнительно узком слое, разделяющем исходную смесь и продукты и распространяющемся по горючей смеси в виде т. наз. волны Г. В неперемешанных системах возможно диффузионное Г., при котором реакция локализуется в относительно тонкой зоне, отделяющей горючее от окислителя, и определяется скоростью диффузии реагентов в эту зону.
Объемное горение происходит, напр., в теплоизолиров. реакторе идеального перемешивания (см. безградиентный реактор), в который поступает при температуре Т0 исходная смесь с относит. содержанием горючего а0; при другой температуре Г реактор покидает смесь с иным относит. содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме Г. могут быть записаны уравнениями:
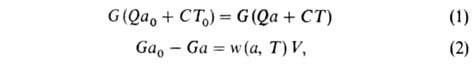
где w(а, Т)-скорость реакции Г., К-объем реактора. Используя выражение для термодинамич. температуры ТГ, можно из (1) получить: а = а0(ТГ — Т)/(ТГ — Т0) и записать (2) в виде:
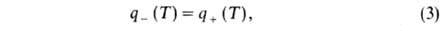
где q-(T) = GC(T- Т0)-скорость отвода тепла из реактора с продуктами сгорания, q+(T) = Qw(a, Т) V-скорость выделения тепла при реакции. Для реакции и-го порядка с энергией активации:
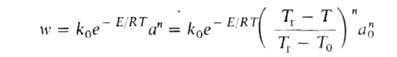
(k0-предэкспоненц. множитель в уравнении Аррениуса). На диаграмме q — Т (рис. 1) зависимость q-(T)выражается прямой линией, угол наклона которой тем больше, чем больше расход через реактор; q + (T)выражается кривой с резким максимумом вблизи ТГ. Восходящая ветвь этой кривой обусловлена быстрым ростом скорости реакции с температурой (в выражении для w осн. вклад дает экспоненц. множитель); при значит. выгорании горючего смесь сильно разбавляется продуктами, преобладающее влияние на скорость реакции начинает давать множитель аn и реакция резко замедляется. Поскольку для реакций Г. характерны большие значения Е, максимум на кривой q+(T)выражен очень резко и сильно смещен к ТГ, т. е. Наиб. быстро реагирует смесь, сильно нагретая выделяющимся теплом, хотя и значительно разбавленная продуктами. При разл. расходах G условия баланса (1) и (2), которым отвечают точки пересечения q+ (T)и q-(Т), могут выполняться при разл. температурах. Соответственно и реакция может протекать по-разному: в низкотемпературном режиме без прогрессирующего самоускорения, с незначит. саморазогревом (Т Т0) и выгоранием горючего (а
Т0) и выгоранием горючего (а а0) (точка А на рис. 1 при расходе Gt) или в режиме Г. при высоких температурах (Т
а0) (точка А на рис. 1 при расходе Gt) или в режиме Г. при высоких температурах (Т ТГ) и больших степенях выгорания (а
ТГ) и больших степенях выгорания (а 0) (точка С на рис. 1 при расходе G3). Переходы между этими двумя режимами-воспламенение смеси и ее погасание-происходят скачкообразно при критич. расходах GB и GП соотв., причем всегда GB < GП. При промежут. расходах GB < G < GП возможен также неустойчивый режим протекания реакции при некоторой промежут. температуре (точка В на рис. 1 при расходе G2), когда любое малое случайное возмущение расхода приводит реакцию в один из устойчивых режимов (А' или С). Гистерезисный эффект, свойственный Г., заключается в том, что при любом расходе G в интервале от GB до GП м. б. реализованы оба устойчивых режима — высокотемпературный (собственно Г.) и низкотемпературный, в зависимости от того, достигнуто ли данное значение G увеличением расхода со стороны значений, меньших GB, или уменьшением его со стороны значений, больших GП.
0) (точка С на рис. 1 при расходе G3). Переходы между этими двумя режимами-воспламенение смеси и ее погасание-происходят скачкообразно при критич. расходах GB и GП соотв., причем всегда GB < GП. При промежут. расходах GB < G < GП возможен также неустойчивый режим протекания реакции при некоторой промежут. температуре (точка В на рис. 1 при расходе G2), когда любое малое случайное возмущение расхода приводит реакцию в один из устойчивых режимов (А' или С). Гистерезисный эффект, свойственный Г., заключается в том, что при любом расходе G в интервале от GB до GП м. б. реализованы оба устойчивых режима — высокотемпературный (собственно Г.) и низкотемпературный, в зависимости от того, достигнуто ли данное значение G увеличением расхода со стороны значений, меньших GB, или уменьшением его со стороны значений, больших GП.
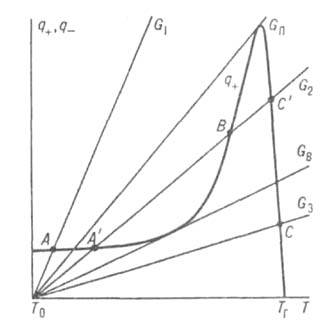
Рис. 1. Зависимость скоростей тепловыделения q+ и теплоотвода q- от температуры Т реагирующей системы при разл. значениях расхода через реактор С (пояснения в тексте); Т0 — температура окружающей среды. ТГ — адиабатич. температура горения.
Критич. и гистерезисные явления, характерные для Г., возникают не только при изменении расхода, но и при изменении др. внеш. условий (Т0, V и т. д.).
Волны горения обусловлены характерным свойством Г. — способностью к распространению в пространстве, занятом горючей смесью. Начавшись в одном слое горючей смеси, заполняющей к.-л. объем, напр. трубу, реакция Г. инициируется в соседних слоях вследствие их нагрева горячими продуктами или из-за диффузии активных центров из реагирующего слоя. В результате возникает распространяющийся вдоль трубы фронт Г., перед которым находится горючая смесь при начальной температуре Т0, за ним-продукты сгорания при температуре ТП. При отсутствии потерь тепла через стенки трубы ТП = ТГ. В стационарном режиме Г. все точки плоского волнового фронта перемещаются с одинаковой скоростью м, постоянной во времени. Скорость реакции w, температура Т и концентрация горючей компоненты а распределены во фронте Г. неравномерно, образуя вдоль координаты распространения фронта х три зоны (рис. 2). В т. наз. зоне реакции 1 температура принимает значения в узком интервале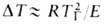 вблизи ТГ, а скорость реакции максимальна. В зоне прогрева 2 скорости реакции и тепловыделения существенно меньше, осн. роль в тепловом балансе смеси играет тепловой поток из зоны реакции. Под воздействием этого потока горючая смесь настолько быстро нагревается до высоких температур, что компоненты не успевают прореагировать. В зоне диффузии 3 осуществляется молекулярное смешение компонентов горючей смеси и продуктов реакции. В результате диффузии концентрация горючего в зоне реакции сильно снижается и смесь обогащается продуктами Г. Значения ширины зоны прогрева lТ и зоны диффузии lD определяются коэф. температуропроводности смеси х и диффузии продуктов D соотв.:
вблизи ТГ, а скорость реакции максимальна. В зоне прогрева 2 скорости реакции и тепловыделения существенно меньше, осн. роль в тепловом балансе смеси играет тепловой поток из зоны реакции. Под воздействием этого потока горючая смесь настолько быстро нагревается до высоких температур, что компоненты не успевают прореагировать. В зоне диффузии 3 осуществляется молекулярное смешение компонентов горючей смеси и продуктов реакции. В результате диффузии концентрация горючего в зоне реакции сильно снижается и смесь обогащается продуктами Г. Значения ширины зоны прогрева lТ и зоны диффузии lD определяются коэф. температуропроводности смеси х и диффузии продуктов D соотв.: 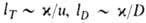 . Ширина зоны реакции lр для простой одностадийной реакции во много раз меньше lТ: lр/lT ~ RTT2/E(TГ — Т0). В случаях реакции со сложным механизмом (напр., при сильном торможении реакции продуктом) lр м. б. сравнима и даже превосходить lТ.
. Ширина зоны реакции lр для простой одностадийной реакции во много раз меньше lТ: lр/lT ~ RTT2/E(TГ — Т0). В случаях реакции со сложным механизмом (напр., при сильном торможении реакции продуктом) lр м. б. сравнима и даже превосходить lТ.
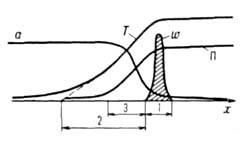
Рис. 2. Изменение скорости реакции w, температуры Т реагирующей системы, концентраций горючего а и продуктов П вдоль координаты х распространения фронта горения; 1 — зона реакции, 2 — зона прогрева, 3 — зона диффузии.
В соответствии с текущими значениями Т и а распределена во фронте Г. и полная энтальпия смеси Н (рис. 3). При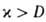 нагретые слои, обогащенные горючей смесью, имеют избыток энтальпии по сравнению с энтальпией H0 исходной смеси
нагретые слои, обогащенные горючей смесью, имеют избыток энтальпии по сравнению с энтальпией H0 исходной смеси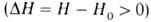 ; при
; при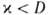 недостаточно прогретая и сильно разбавленная продуктами смесь имеет недостаток энтальпии
недостаточно прогретая и сильно разбавленная продуктами смесь имеет недостаток энтальпии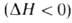 . Избыток энтальпии во фронте Г. — причина неустойчивости стационарных волн Г. и возникновения колебательных режимов их распространения.
. Избыток энтальпии во фронте Г. — причина неустойчивости стационарных волн Г. и возникновения колебательных режимов их распространения.
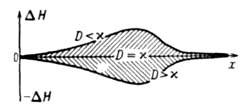
Рис. 3. Изменение энтальпии Н реагирующей системы вдоль координаты х распространения фронта горения; 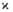 и D-коэффициенты температуропроводности смеси и диффузии продуктов соответственно.
и D-коэффициенты температуропроводности смеси и диффузии продуктов соответственно.
При сложных реакциях, протекающих по многостадийному механизму, структура фронта Г. может оказаться более сложной, чем в случае простой (одностадийной) реакции. В зависимости от соотношения между кинетич. константами разл. стадий сложной реакции эти стадии могут либо протекать в одной зоне (режим слияния), либо могут быть пространственно разделенными и взаимод. между собой посредством тепловых и диффузионных потоков (режим управления), либо не будут испытывать никакого взаимного влияния (режим отрыва). Скорость распространения фронта Г. с неск. зонами реакции, как правило, определяется к.-л. одной из них (т. наз. ведущая зона).
Количество горючего, сгорающего на единице поверхности фронта Г. в единицу времени, наз. массовой скоростью Г. т. Она определяется выражением: 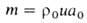
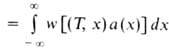 , где
, где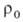 -плотность исходной смеси.
-плотность исходной смеси.
Расчет скоростей Г. — массовой m и линейной u-связан с отысканием распределения температур и концентраций всех компонентов смеси во фронте Г. и требует совместного решения дифференц. уравнений тепло- и массопереноса в реагирующей среде. Согласно Зельдовичу-Франк-Каменецкому, для простой (одностадийной) реакции

где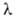 -теплопроводность смеси,
-теплопроводность смеси, 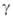 = RT2Г/E(TГ — T0); значения
= RT2Г/E(TГ — T0); значения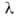 и w соответствуют температуре ТГ, плотности смеси
и w соответствуют температуре ТГ, плотности смеси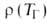 и эффективной концентрации горючего в зоне реакции
и эффективной концентрации горючего в зоне реакции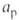 =
=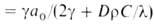 . Из этой формулы следует, что из всех физ.-хим. свойств горючей смеси и характеристик тепло- и массопе-реноса наиб. влияние на т оказывает температура ТГ, поскольку зависимость т от ТГ соответствует экспоненц. закону, т. е.
. Из этой формулы следует, что из всех физ.-хим. свойств горючей смеси и характеристик тепло- и массопе-реноса наиб. влияние на т оказывает температура ТГ, поскольку зависимость т от ТГ соответствует экспоненц. закону, т. е.
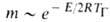
В реальных условиях распространение фронта Г. всегда сопровождается потерями тепла во внеш. среду (излучением, теплопроводностью), что приводит к уменьшению температуры и скорости Г. по сравнению с их адиабатич. значениями. Если отношение интенсивности теплопотерь к мощности тепловыделения превышает некоторое критич. значение, самораспространение реакции по горючей смеси становится невозможным. Срыв Г. с ростом теплопотерь осуществляется скачком: непосредственно перед потуханием скорость Г. отлична от нуля и даже м. б. близка к скорости адиабатич. Г. Со срывом Г. вследствие теплопотерь связаны понятия разл. пределов Г. Так, если содержание воздуха в горючей смеси становится меньше стехиометрического, сильно уменьшаются скорости реакции и тепловыделения. При неизменной теплоотдаче это приводит к росту отношения интенсивности теплопотерь к мощности тепловыделения. При некоторой концентрации горючего это отношение достигает критич. значения, ниже которого смесь становится негорючей в данных условиях; соответствующая концентрация горючего наз. концентрационным пределом Г. Аналогично определяются пределы Г. по начальной температуре, давлению, диаметру трубы и т. п.
Диффузионное горение имеет место в условиях, когда горючее и окислитель диффундируют в зону реакции с противоположных сторон; таково, напр., Г. свечи, фитиля. Если при этом константа скорости k реакции Г. много меньше константы скорости диффузии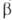 , реагенты успевают перемещаться и реакция протекает в обычном кинетич. режиме (относительно низкотемпературном). При
, реагенты успевают перемещаться и реакция протекает в обычном кинетич. режиме (относительно низкотемпературном). При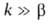 реагенты взаимод. тотчас же после их поступления в зону реакции, прежде чем они полностью перемешаются, и реакция протекает в режиме Г., т. е. при высоких температурах. Отношение диффузионных потоков реагентов определяется стехиометрией реакции; концентрации горючего и окислителя в зоне реакции малы, осн. компонент смеси-продукты сгорания, которые диффундируют в области, занятые горючим и окислителем (рис. 4). Выделяющееся при реакции тепло передается горючему и окислителю, которые поступают в зону реакции нагретыми до высокой температуры. В отличие от Г. перемешанных смесей, температура диффузионного Г. зависит от отношения
реагенты взаимод. тотчас же после их поступления в зону реакции, прежде чем они полностью перемешаются, и реакция протекает в режиме Г., т. е. при высоких температурах. Отношение диффузионных потоков реагентов определяется стехиометрией реакции; концентрации горючего и окислителя в зоне реакции малы, осн. компонент смеси-продукты сгорания, которые диффундируют в области, занятые горючим и окислителем (рис. 4). Выделяющееся при реакции тепло передается горючему и окислителю, которые поступают в зону реакции нагретыми до высокой температуры. В отличие от Г. перемешанных смесей, температура диффузионного Г. зависит от отношения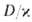 . При
. При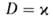 она совпадает с температурой Г. перемешанной стехиометрич. смеси горючего и окислителя, с уменьшением
она совпадает с температурой Г. перемешанной стехиометрич. смеси горючего и окислителя, с уменьшением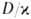 — падает. По этой причине диффузионное Г. не реализуется в конденсиров. средах, для которых значения
— падает. По этой причине диффузионное Г. не реализуется в конденсиров. средах, для которых значения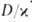 очень малы; помимо газофазных систем, диффузионное Г. характерно для гетерог. реакций на поверхности (Г. твердых веществ, гетерог.-каталитич. Г.). Массовая скорость m диффузионного Г. определяется скоростью диффузии реагентов в зону реакции. Рост m с увеличением скорости диффузии возможен лишь до определенного предела. Это предельное значение m близко по величине к массовой скорости Г. в пламени, распространяющемся по стехиометрич. смеси горючего и окислителя. По достижении предельного значения m p-ция переходит в низкотемпературный кинетич. режим (происходит срыв Г.). От начальной температуры реагентов Т0 m практически не зависит, однако при некотором минимальном для данного набора остальных параметров значении Г0 диффузионное Г. невозможно.
очень малы; помимо газофазных систем, диффузионное Г. характерно для гетерог. реакций на поверхности (Г. твердых веществ, гетерог.-каталитич. Г.). Массовая скорость m диффузионного Г. определяется скоростью диффузии реагентов в зону реакции. Рост m с увеличением скорости диффузии возможен лишь до определенного предела. Это предельное значение m близко по величине к массовой скорости Г. в пламени, распространяющемся по стехиометрич. смеси горючего и окислителя. По достижении предельного значения m p-ция переходит в низкотемпературный кинетич. режим (происходит срыв Г.). От начальной температуры реагентов Т0 m практически не зависит, однако при некотором минимальном для данного набора остальных параметров значении Г0 диффузионное Г. невозможно.
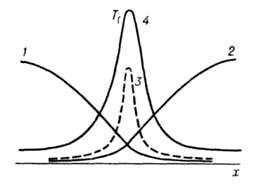
Рис. 4. Распределение концентрации окислителя (1), горючего (2), продуктов реакции (3) и температуры смеси (4) во фронте диффузионного горения; х-пространственная координата, ТГ-адиабатич. температура горения.
Особенности горения в различных средах.
При Г. газовых смесей на скорость распространения фронта Г. (пламени) и форму его поверхности существенно влияет гидродинамич. течение среды. Скорость и распространения пламени по неподвижной среде зависит от состава смеси, температуры и давления и является физ.-хим. характеристикой смеси. Она наз. нормальной, или фундаментальной, скоростью Г. Для реакции и-го порядка и ~ ~ ехр(E/2RТГ)*рn/2−1, где р — давление. Для разл. горючих смесей и составляет от неск. см/с до десятков м/с. Наблюдаемая скорость распространения пламени отличается от и из-за движения газа перед фронтом Г., напр. вследствие термич. расширения продуктов при распространении пламени от закрытого конца трубы к открытому. При Г. в больших объемах расширение продуктов приводит к гидродинамич. неустойчивости пламени — самопроизвольному искривлению его поверхности, образованию на ней ячеистых структур и др.
В ламинарно движущейся горючей смеси пламя распространяется со скоростью и в направлении, нормальном к его поверхности. Пламя имеет стабилизированную в пространстве форму при условии, что и равна нормальной составляющей скорости потока VH. В случае вытекания из горелки радиуса r заранее перемешанной смеси со скоростью потока v = const стабилизированная поверхность пламени (т. н. факел) имеет форму конуса с высотой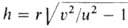 . Г увеличением расхода горючего поверхность пламени увеличивается, обеспечивая сгорание всей смеси. В случае диффузионного Г., напр. при ламинарном истечении горючего в атмосферу окислителя, форма пламени определяется условием равенства нулю на его поверхности концентраций горючего и окислителя.
. Г увеличением расхода горючего поверхность пламени увеличивается, обеспечивая сгорание всей смеси. В случае диффузионного Г., напр. при ламинарном истечении горючего в атмосферу окислителя, форма пламени определяется условием равенства нулю на его поверхности концентраций горючего и окислителя.
При турбулентном течении горючей смеси пульсации потока интенсифицируют тепло- и массоперенос в пламени, искривляют и дробят его поверхность, расширяют зону реакции, что приводит к резкому ускорению Г. Скорость распространения турбулентного пламени может превосходить и в десятки и сотни раз. В сильно шероховатых трубах турбулизация потока и ускорение пламени могут даже привести к переходу Г. в детонацию.
В конденсированных (безгазовых) системах ведущая Г. экзотермич. реакция протекает в твердой или жидкой фазе с образованием конденсиров. продуктов; газофазные вещества либо не участвуют в реакции, либо не влияют на распространение фронта Г. Примеры подобных процессов-Г. некоторых термитных составов (смесей порошков оксидов и металлов-восстановителей), самораспространяющийся высокотемпературный синтез, фронтальная полимеризация. Для Г. безгазовых смесей характерна высокая плотность выделения энергии, скорость Г. для разл. систем принимает значения от 10−1 до 10 см/с и постоянна в широком интервале изменения давления; отсутствует диффузия продуктов в исходную смесь, изменение концентрации реагентов происходит только в пределах зоны реакции (зоны 1и 3 на рис. 2 сливаются в одну). Такая структура фронта Г. обусловливает макс. количество избыточной энтальпии в прогретом слое вещества перед зоной реакции. В сочетании с высокой температурной чувствительностью скорости реакции (сверхкритич. значения энергии активации реакции Е) это может привести к возникновению автоколебаний фронта Г. с резкими пульсациями температуры и скорости Г. Если поверхность фронта велика, колебания отд. точек теряют синхронность и возникают пространственно неоднородные нестационарные эффекты, напр. т. наз. спиновое Г., при котором реакция локализуется в небольшом ярком пятне, движущемся по спирали с пост. скоростью в сторону несгоревшего вещества (рис. 5). При Г. смесей порошков, напр. металла с углеродом, часто возникают широкие (намного превышающие зону прогрева) зоны тепловыделения, обусловленные сильным торможением реакции продуктами. Интенсивная реакция, определяющая скорость распространения фронта Г., протекает при температурах, намного меньших ТГ, дальнейшее догорание растягивается на большое пространство.

Рис. 5. Спиновое горение тантала в азоте: 1 сгоревшая часть образца (светятся горячие продукты горения); 2 — очаг реакции, распространяющийся по спирали (стрелка указывает направление движения); 3 — несгоревшая часть образца (исходное вещество).
При Г. газифицирующихся конденсированных систем (напр., твердых и жидких ВВ) происходит интенсивное газовыделение вследствие испарения горючего или его хим. разложения, обусловленных потоком тепла из зоны Г. Ведущая Г. экзотермич. реакция может протекать в образующейся газовой фазе (т. наз. летучие системы) либо в конденсиров. фазе (нелетучие системы). Стационарное Г. летучих систем описывается той же теорией, что и Г. газовых смесей с заранее перемешанными компонентами. В нелетучих системах выделение большого количества газообразных продуктов может приводить к мех. разрушению и диспергированию вещества вблизи поверхности. В результате зона реакции сильно растягивается и тепловыделение происходит в осн. в мелкодисперсной смеси частиц горючего и продуктов его первичного хим. разложения. Линейные скорости и Г. порохов и других ВВ составляют от долей мм/с до десятков см/с; аномально высокие и (десятки м/с) наблюдаются при проникновении горячих газообразных продуктов в поры гранулированного твердого топлива (конвективное Г.). Как и при Г. газов, для и характерна степенная зависимость от р типа и ~ pv, где v > 0. Г. может сопровождаться нестационарными эффектами: погасанием при сбросе давления, колебаниями скорости и температуры, искривлением поверхности фронта и др., обусловленными избытком энтальпии в прогретом слое топлива и большим различием в плотности конденсиров. и газовой фаз.
Г. гетерогенных систем — твердых или жидких топлив в газообразном окислителе — может происходить так же, как и Г. гомогенных газовых смесей, если перемешивание компонентов происходит достаточно быстро и не лимитирует реакцию (напр., при распылении топлива из форсунки). При низкой дисперсности частиц горючего осуществляется режим диффузионного Г. При Г. капли жидкого топлива вокруг нее образуется диффузионное пламя, поддерживающее интенсивное испарение. Время диффузионного Г. частиц топлива пропорционально квадрату их размера. Помимо миним. размера, отвечающего пределу интенсификации диффузионного Г., существует макс. размер частицы, при котором топливо не может гореть вследствие радиац. теплопотерь.
Распространение пламени по взвеси частиц топлива в газе (аэровзвеси) протекает с большими скоростями ( ~ 10 м/с) вследствие того, что световое излучение от горящих частиц топлива нагревает исходную смесь на больших расстояниях перед фронтом Г. В больших объемах Г. аэровзвеси может переходить в детонацию вследствие самоускорения пламени, а также из-за автотурбулизации течения газа горящими частицами твердого топлива.
При Г. пористых веществ, напр. слоя частиц угля, распространение фронта Г. сопровождается фильтрац. течением газа, содержащего окислитель. Оно может возникать самопроизвольно вследствие поглощения либо выделения газа при реакции или вынужденно, из-за задаваемого перепада давления. Температура и состав продуктов зависят от кинстич., теплофиз. и фильтрац. характеристик системы. Температура Г. при вынужденной фильтрации окислителя через продукты может в неск. раз превышать Тр, рассчитанную на полное сгорание горючего, содержащегося в пористой среде. Например, при фильтрац. выжигании нефтяного песка температура в зоне реакции может составлять 600–800 °C при расчетной термодинамич. температуре Г., равной 250–350 °C. Такое повышение температуры смеси в зоне реакции осуществляется за счет тепла, отбираемого газовым потоком у охлаждаемой части продуктов. При низком содержании окислителя в потоке газа все продукты могут оказаться охлажденными до температуры вдуваемого газа, а горючее вещество — разогретым до температуры Г. на большом расстоянии перед зоной реакции. Др. характерные эффекты — неполное сгорание, срывы Г. при отсутствии внеш. теплопотерь, аномально низкие значения и (10−1-1 см/мин). Возможны и нестационарные явления — автоколебания фронта Г., спиновое Г., образование ячеистых структур во фронте Г.
В макрогетерог. системах (крупные куски угля, пластины полимеров в атмосфере окислителя) возможно распространение диффузионного пламени вдоль поверхности горючего материала. Скорость Г. определяется тепло- и массоперено-сом в передней кромке пламени и зависит от величины и направления потока газа, концентрации в нем окислителя, свойств горючего.
Практич. применения Г. развиваются по двум направлениям-энергетическому, в котором Г. используется для выделения энергии топлива, и технологическому, в котором назначение Г. — получение целевого продукта. Первое направление составляют теплоэнергетика, моторостроение, ракетная техника, разработка МГД-генераторов и др.; второе — доменный процесс, металлотермия, неполное сжигание углеводородов в производстве сажи, ацетилена, этилена, самораспространяющийся высокотемпературный синтез, разработка нефтяных месторождений путем внутрипластового Г. и др. Изучение Г. имеет первостепенное значение в разработке научных основ пожаро- и взрывобезопасности (см. пожарная опасность).
Лит.: Хитрин Л. Н., Физика горения и взрыва, М., 1957; Льюис Б., Эльбе Г., Горение, пламя и взрывы в газах, пер. с англ., 2 изд., М., 1968; Процессы горения в химической технологии и металлургии, Черноголовка, 1975; Мержанов А. Г., Руманов Э. Н., Горение без топлива, М., 1978; Математическая теория горения и взрыва, М., 1980; Теория горения и взрыва, М., 1981.
А. Г. Мержанов, А. П. Алдушин
Значения в других словарях
- ГОРЕНИЕ — Сложная хим. реакция, протекающая в условиях прогрессивного самоускорения, связанного с накоплением в системе теплоты или катализирующих продуктов реакции. При Г. могут достигаться высокие (до неск. тыс. Физический энциклопедический словарь
- горение — -я, ср. Действие и состояние по глаг. гореть (в 1, 2 и 5 знач.). Малый академический словарь
- горение — Экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма. [137] Строительная терминология
- горение — Гор/е́ни/е [й/э]. Морфемно-орфографический словарь
- Горение — Сложное, быстро протекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем). В большинстве случаев основу Г. составляют экзотермические окислительные реакции вещества, способного... Большая советская энциклопедия
- горение — орф. горение, -я Орфографический словарь Лопатина
- горение — ГОРЕНИЕ см. Гореть. Толковый словарь Кузнецова
- горение — См. гореть Толковый словарь Даля
- горение — ГОР’ЕНИЕ, горения, мн. нет, ср. (·книж. ). Действие и состояние по гл. гореть. Горение газа. Душевное горение. Толковый словарь Ушакова
- горение — горение I ср. 1. Процесс действия по гл. гореть I 1., 2., 3., 4. 2. Результат такого действия. II ср. 1. Процесс действия по гл. гореть II 2. Результат такого действия. Толковый словарь Ефремовой
- ГОРЕНИЕ — ГОРЕНИЕ — физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло- и массообменом с окружающей средой. Большой энциклопедический словарь
- Горение — (фр. и англ. combustion, нем. Verbrennung; хим.) — принято называть Г. такие случаи взаимодействия с кислородом воздуха каких бы то ни было тел, которые сопровождаются значительным выделением тепла, а иногда и света. В более общем смысле можно считать... Энциклопедический словарь Брокгауза и Ефрона
