диеновые углеводороды
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (диены)
ненасыщенные углеводороды с двумя двойными связями. Алифатич. диены CnH2n_2 наз. алкадиенами, алициклич. CnH2n_4 — циклоалкадиенами. В статье рассматриваются Д.у. с сопряженными двойными связями [сопряженные диены; см. табл.]. Диены с изолированными двойными связями по химическим свойствам в осн. не отличаются от олефинов. О соед. с кумулированными двойными связями см. аллены. В Д.у. все четыре атома углерода сопряженной системы имеют sp2-гибридизацию и лежат в одной плоскости. Четыре р-электрона (по одному от каждого атома углерода) комбинируются, образуя четыре π-молекулярные орбитали (две связывающих — занятые и две разрыхляющих — свободные), из которых только низшая делокализована по всем атомам углерода. Частичная делокализация π-электронов обусловливает эффект сопряжения, проявляющийся в уменьшении энергии системы (на 13–17 кДж/моль по сравнению с системой изолированных двойных связей), выравнивании межатомных расстояний: двойные связи несколько длиннее (0,135 нм), а простые — короче (0,146 нм), чем в молекулах без сопряжения (соотв. 0,133 и 0,154 нм), повышении поляризуемости, экзальтации молекулярной рефракции и др. физ. эффектах. Д. у. существуют в виде двух конформаций, переходящих друг в друга, причем s-транс-форма более устойчива:
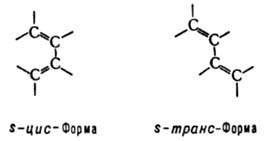
В УФ спектрах Д. у. длинноволновый максимум поглощения сдвинут по сравнению с олефинами в область больших длин волн (батохромный сдвиг) и соответствует для 1,3-бутадиена длине волны 217 нм, изопрена — 220 нм, 2,3-диметил-1,3-бутадиена — 226 нм. Частота валентных колебаний связей углерод-углерод лежит в области 1580–1660 см−1. Сигналы протонов групп СН в спектрах ЯМР1Н находятся в области 5,8–6,4 м. д. (по шкале d). Наличие единой системы сопряженных связей обусловливает повыш. реакционная способность Д. у. по сравнению с олефинами. Для них характерны реакции по концам системы сопряженных связей (наряду с реакциями, протекающими по одной из них), сопровождающиеся раскрытием обеих двойных связей и образованием связи между срединными атомами углерода: C=C—C=C → C—C=C—С.
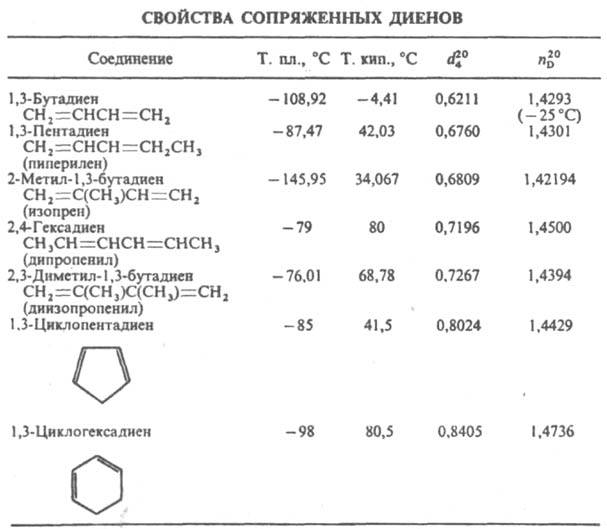
Алифатич. Д. у. полимеризуются и сополимеризуются с разл. виниловыми мономерами с образованием каучуков, каучукоподобных сополимеров, термоэластопластов. Они самопроизвольно димеризуются с образованием, напр., 4-винилциклогексана из бутадиена и дипентена из изопрена.
• см. также диеновый синтез
Присоединение SO2 к Д. у. приводит к образованию циклич. сульфонов, напр.:
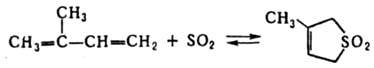
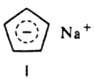
Обратимость реакции при повышенной температуре позволяет использовать ее для выделения Д. у. из смеси с близкокипящими олефинами и парафинами. Присоединение к Д. у. водорода, галогенов и галогеноводородов происходит как по концам системы сопряженных связей (1,4-присоединение), так и по одной из двойных связей [1,2(3,4)-присоединение]. Направление реакции зависит от природы Д. у. и реагента, катализатора, условий опыта. В этих реакциях термодинамически выгоднее образование продуктов 1,4-присоединения, однако быстрее образуются продукты 1,2-присоединения (кинетич. контроль реакции), способные перегруппировываться в продукты 1,4-присоединения. Присоединение галогеноводородов к Д. у. в большинстве случаев протекает в соответствии с правилом Марковникова. С щелочными металлами 1,3-циклопентадиен образует солеобразные соед., содержащие ароматич. циклопентадиенид-анион, напр., формула I. Д. у. образуют π-комплексы при взаимодействии с солями, карбонилами и др. производными Fe, Co, Ni, Cr и др. переходных металлов (см., напр., ферроцен). В присут. кислорода Д. у. образуют пероксиды, инициирующие их полимеризацию.
В промышленности Д. у. получают каталитич. дегидрированием алканов или алкенов и выделением из продуктов каталитич. или термич. крекинга нефти и нефтепродуктов, проводимого с целью получения этилена. Д. у. могут быть также получены дегидратацией насыщенных диолов, ненасыщенных спиртов, дегидрогалогенированием насыщенных дигалогенидов, частичным гидрированием винилацетиленов, расщеплением 1,4-диаминов и др. Для качеств. и количеств. определения Д. у. используют их реакцию с малеиновым ангидридом, приводящую к получению аддуктов со след. т. пл.: бутадиен 103–104 °C, изопрен 63 64 °C, пиперилен 62 °C, 2,3-диметилбутадиен 78–79 °C. Д. у. применяют в промышленности для производства синтетич. каучуков (бутадиен, изопрен, циклопентадиен и др.), смол АБС, высокостирольных сополимеров и термоэластопластов, полиамидных волокон, пластификаторов (бутадиен), лаков и красок, инсектицидов (бутадиен, циклопентадиен), антипиренов, лекарств (циклопентадиен) и др. Мировые мощности по производству Д. у. составляют ок. 9 млн. т/год (1981). Д. у. вредно влияют на центр. нервную систему. В газообразном и парообразном виде раздражают слизистые оболочки. При хронич. отравлении вызывают нарушение гемодинамики, дистрофич. изменения паренхиматозных органов, отчетливое раздражение кроветворных органов.
Лит.: Химия алкенов, пер. с англ., Л., 1969; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 233–81; Терней А., Современная органическая химия, пер. с англ., т. 1, М., 1981, с. 495–535; Фельдблюм В. Ш., Синтез и применение непредельных циклических углеводородов, М., 1982; Губин С. П., Голоунин А. В., Диены и их π-комплексы, Новосиб., 1983.
Ф. Е. Куперман
Значения в других словарях
- Диеновые углеводороды — Диены, диолефины, непредельные углеводороды с двумя двойными связями. В зависимости от взаимного расположения двойных связей в молекуле различают: 1) Д. у. с изолированными двойными связями, например пентадиен-1,4 и др. Большая советская энциклопедия
- ДИЕНОВЫЕ УГЛЕВОДОРОДЫ — ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (диены) — ненасыщенные углеводороды, содержащие в молекуле 2 двойные связи (С=С). По взаимному расположению последних различают диеновые углеводороды с кумулированными (напр., аллен CH2=C=CH2) — сопряженными (напр. Большой энциклопедический словарь
