координационные соединения
КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ (комплексные соединения)
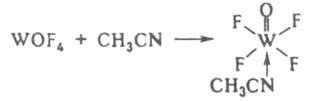
содержат катионный, анионный или нейтральный комплекс, состоящий из центр. атома (или иона) и связанных с ним молекул или ионов — лигандов. Центр. атом (комплексообразователь) — обычно акцептор, а лиганды — доноры электронов, и при образовании комплекса между ними возникает донорно-акцепторная, или координационная, связь. Комплекс м. б. электронейтральным, или неэлектролитом, иметь положит. заряд (комплексный катион) или отрицательный (комплексный анион). В случае образования К. с. с одноименными лигандами все связи в комплексе равноценны, если он находится в растворе или газовой фазе, а в случае разнородных лигандов характер связи зависит от их свойств, напр. в комплексе [W(CH3CN)(O)F4] реализуются донорно-акцепторная, ковалентные простые и кратная связи:
Число атомов лигандов, координированных центр. атомом, — координационное число (к. ч.) — обычно превышает его степень окисления. Лиганды, связанные с центр. атомом, образуют внутр. координац. сферу комплексного соединения. В растворе комплекс сохраняет индивидуальность, хотя может иметь место и диссоциация:
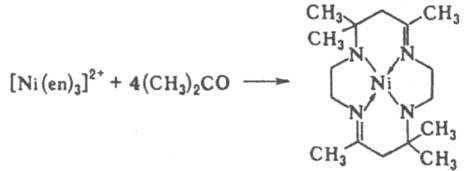
[P(CH3CN)F5]DPF5+CH3CN [Cu(en)3]2+D[Cu(en)2]2++en
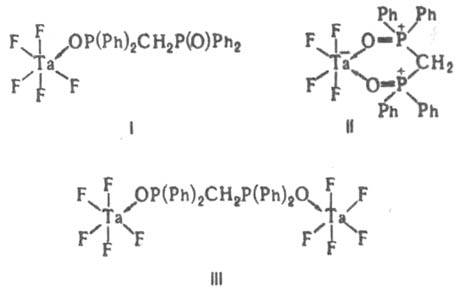
(en — этилендиамин). Анионы или катионы (противоионы), входящие вместе с комплексом в состав К. с., образуют вторую (внешнюю) сферу. В зависимости от числа донорных атомов лиганда, способных к координации, различают моно-, би- и ... полидентатные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центр. атому, наз. хелатными, а координирующиеся к разл. центр. ионам,-мостиковыми. Комплексы, в которых лиганды связывают два или более центр. ионов, наз. би- или полиядерными (многоядерными, см. полиядерные соединения). Полиядерные комплексы, имеющие хим. связи между центр. атомами, наз. кластерами. Одни и те же лиганды, напр. Ph2P(O)CH2P(O)Ph2, в зависимости от условий могут выступать в роли монодентатных, хелатных и мостиковых (формулы I-III соотв.).
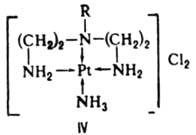
Одноатомные лиганды, напр. F−, также могут выступать в качестве мостиковых: [F5Ta—F—TaF5]−. К. с., содержащие циклич. комплексы металлов с полидентатными лигандами, в которых центр. атом входит в один или неск. циклов, наз. хелатами (напр., IV).
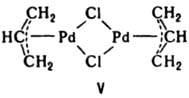
Номенклатура К. с. Назв. комплексного катиона записывают одним словом, начало которого составляет назв. отрицат. лигандов с прибавлением соединит. гласной "о", затем перечисляют нейтральные лиганды, именуемые как своб. молекулы, за исключением H2O — аква, МH3 — аммин, CO — карбонил, NO — нитрозил, CS — тиокарбонил, затем называют центр. атом с послед. римской цифрой, указывающей его степень окисления. Число лигандов, назв. которых являются простыми словами, напр. "хлоро", "бромо", "аква", "оксалато", обозначают префиксами "ди", "три", "тстра" и т. д. Если назв. лигандов более сложны, напр. этилендиамин, триалкилфосфин, перед ними ставят префиксы "бис", "трис", "тетракис" и т. д., напр. [Co(NH3)4(NO2)Cl]NO3 нитрат хлоронитротетрамминкобальта (III). Комплексные анионы называют согласно тем же правилам, но с добавлением суффикса "ат" к названию комплексообразователя, напр. К[Pt(НH3)Cl3] — трихлороамминплатинат (III) калия. Нейтральные К. с. обозначают одним словом, образованным по тем же правилам, напр. [Pt(PPh3)2Cl2] — дихлоро-бис-(трифенилфосфин) платина (II). Перед назв. мостиковых лигандов ставят префикс m-, а перед ненасыщенными — префикс η- (см. гапто-), причем, когда все атомы лиганда связаны с центр. атомом, цифровой индекс у η не ставят, напр. m-дихлоро-бис-(η-аллил) дипалладий(II) (формула V).
Формулы К. с. При написании формулы внутр. сферы К. с., содержащей один вид лигандов L, вначале записывают центр. атом М, а затем лиганды с указанием их числа n; всю внутр. сферу заключают в квадратные скобки. Внешнесферные катионы X (также с указанием их числа m) помещают слева от внутр. сферы, а внешнесферные анионы Y — справа: Xm[MLn], [MLn]Ym. Разные по типу заряда лиганды располагают вслед, порядке: [M(L+)(L°)(L−)]. При наличии неск. разных лигандов их отделяют друг от друга круглыми скобками, напр. запись (N2) соответствует одному лиганду диазоту, а запись (N)2 — двум лигандам.
Природа химической связи в К. с. В К. с. — хотя бы одна из связей — донорно-акцепторная, образуется в результате перекрывания заселенных электронами орбиталей лигандов с вакантными орбиталями центр. атома (см. координационная связь). Если лиганд, как, напр., OH−, OR−, NR−2, SR−, O2−, S2−, NR2−, имеет дополнит. неподеленные пары электронов, а центр. атом — подходящие вакантные орбитали, то образуются простые дативные связи. Лиганды, у которых есть вакантные орбитали (как, напр., у PR3, SR2, AsR3) с центр. атомами, имеющими d-электроны, могут образовывать обратные дативные связи π-типа. Оба эффекта приводят к упрочению координац. связи, увеличивая ее кратность. Природу хим. связи в К. с. объясняют с помощью валентных связей метода, электростатич. теории и ее модифнкации - кристаллического поля теории, молекулярных орбиталей методов.
Строение К. с. В пространстве К. с. имеют форму многогранников — координационных полиэдров, в вершинах которых располагаются атомы лигандов, непосредственно связанные с центр. атомом, или неподеленные электронные пары последнего. Комплексы с к. ч. 2, напр. [CuCl2]−, [Ag(CN)2]−, имеют линейное строение, для к. ч. 3 возможно строение плоского равностороннего треугольника, как, напр., [HgI3]− (формула VI) или [Pd(PPh3)3], или тригональной пирамиды. В
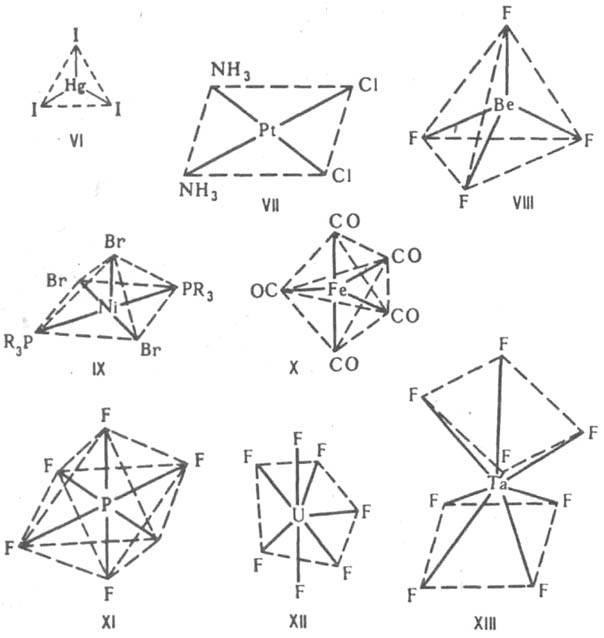
случае к. ч. 4 наиб. часто встречаются конфигурации плоского квадрата, напр. [Pt(NH3)2Cl2] (VII), или тетраэдра, напр. [BF4]−, [BeF4]2− (VIII). Для к. ч. 5 координац. полиэдрыквадратная пирамида, напр. [Ni(PR3)2Br3] (IX), или тригональная бипирамида, напр. [Fe(CO)5] (X). При к. ч. 6 координац. полиэдр обычно октаэдр, напр. [PF6]− (XI), [PtCl6]2−, однако иногда встречается и конфигурация тригональной призмы. Для к. ч. 7 известны конфигурации пентагональной бипирамиды, напр. [ZrF7]3−, [UF7]3− (XII), гранецентрир. тетрагональной призмы, напр. [NbF7]2−, или др. В случае к. ч. 8 координац. полиэдры — квадратная антипризма, напр. [TaF8]3− (XIII), или додекаэдр, напр. [Mo(CN)8]4−. Для к. ч. 9 наблюдается конфигурация гранецентрир. тригональной призмы, которая наиб. широко известна для аквакомплексов лантаноидов, напр. [Nd(H2O)9]3+. В случае к. ч. 10 обнаружены конфигурации додекаэдра с раздвоенными вершинами для [Nd(Me2SO4)4(NO3)3] и двушапочной антипризмы для {[Th(H2O)2(HCOO)4]∙H2O}. Для предсказания конфигурации координац. полиэдра м. б. использована теория отталкивания электронных пар валентной оболочкой, согласно которой конфигурация комплекса определяется миним. отталкиванием всех электронных пар валентной оболочки центр. атома (см. гиллеспи теория).
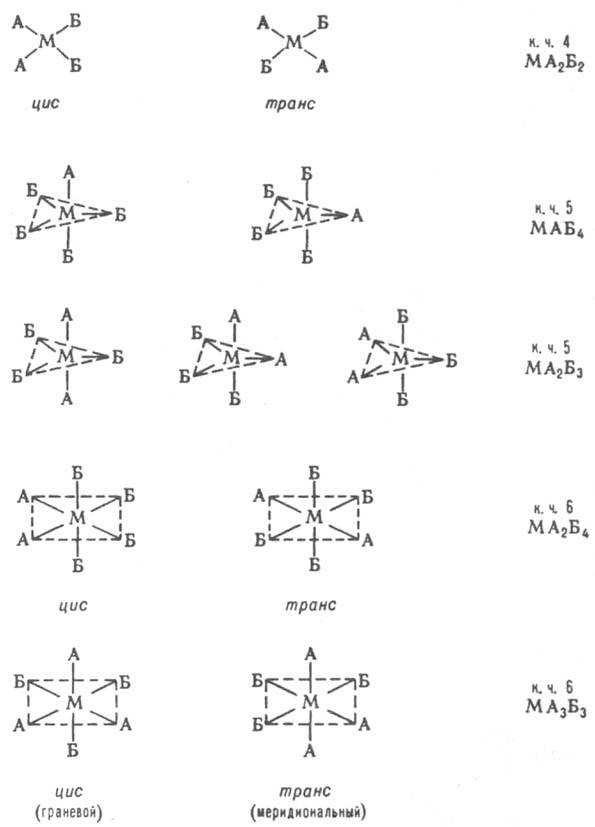
Изомерия К. с. Различают истинно изомерию комплексов, при которой состав внутр. сферы и строение координир. лигандов не меняется (геом., оптич., конформац., связевая), и изомерию с изменением состава координац. сферы или строения лигандов (ионизац., гидратная, координац., лигандная, формальная). Геометрическая (пространственная) изомерия является следствием разл. расположения разнородных лигандов во внутр. сфере комплексов. Возможна в случае к. ч. 4 (только для плоских квадратных комплексов) и более высоких к. ч. Ниже приведены примеры геом. изомеров.
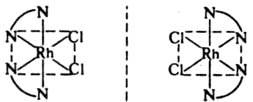
Оптическая изомерия. Простейший пример оптически активного комплекса — тетраэдрич. структура, в которой центр. атом окружен четырьмя разл. лигандами или двумя несимметричными бидентатными лигандами. В случае октаэдрич. конфигурации оптич. изомеры образуют комплексы типа М(АА)3 с симметричными бидентатными лигандами, напр.:

Для комплексов типа М(АА)2В2 оптич. изомеры дают только цис-формы, поскольку транс-форма имеет плоскость симметрии, напр.:
В случае октаэдрич. комплекса с 6 разнородными лигандами каждый из 15 возможных изомеров давал бы оптич. изомеры, напр.:
Конформационная изомерия — способность комплексов изменять форму координац. полиэдра, напр. переходить из плоской квадратной конфигурации в тетраэдрическую:
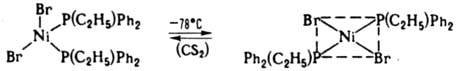
В случае связевой изомерии изменяется способ связывания монодентатно координир. лиганда, имеющего два или более неэквивалентных донорных центра, во внутр. сфере комплекса при сохранении строения лиганда. Например, ион NCS− может координироваться через атомы N или S, NO2− — через атомы N и О, Ph2P(O)CH2C(O)NR2 — через группы Р=О или C=O, R2N(CH2)nNR'2 — через oдин из неэквивалентных атомов N и т. д. Лигандная изомерия обусловлена существованием комплексов с изомерными формами лиганда. Координационная изомерия заключается в полном или частичном изменении состава комплексных аниона или катиона при сохранении состава К. с., напр.:
[Co(NH3)6][Cr(C2O4)3] и [Cr(NH3)6][Co(C2O4)3]
В случае би- или полиядерных комплексов выделяют координац. изомерию положения — изменение состава координац. сфер отдельных центр. ионов при сохранении состава комплекса, напр. соед. XIV и XV.
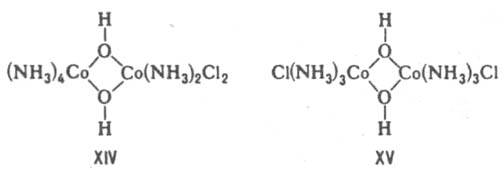
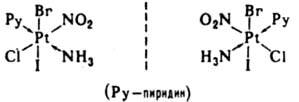
Ионизационная изомерия — способность К. с. одного состава давать в растворе разл. ионы. Примеры ионизац. изомеров: [Pt(NH3)3Br]NO2 и [Pt(NH3)3(NO2)]Br. Частный случай ионизац. изомерии — сольватная (гидратная) изомерия. Примеры гидратных изомеров — [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2 H2O, [Cr(H2O)4Cl2]Cl 2H2O. Формальные изомеры — К. с. одинакового состава и мол. веса, но отличающиеся по составу лигандов, напр.: [Pt(NH3)(NH2C2H5)Cl2] и [Pt(NH2CH3)2Cl2]. Стабильность комплексов. Образование и диссоциация К. с. происходит ступенчато:
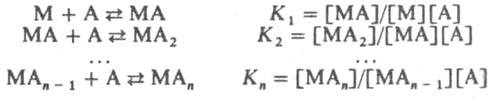
Константы K1 K2, ... ,Kn наз. ступенчатыми константами образования (устойчивости). Для обозначения полных констант образования используют символ β:
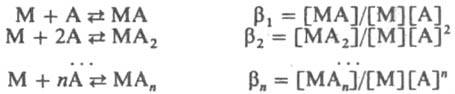
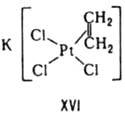
При этом βn является произведением ступенчатых констант: βn=K1K2...Kn, Константы Kn и βn — термодинамич. характеристики устойчивости комплекса в растворе. Величины, обратные Kn или βn, наз. константами диссоциации или нестойкости. Различают термодинамич. стабильность К. с. — меру возможности образования комплекса или его превращения в др. соед. в равновесных условиях- и кинетическую, описывающую скорость реакций комплексов, ведущих к достижению равновесия. Термодинамич. стабильность комплекса характеризуется терминами "устойчивый", "неустойчивый", кинетическая — терминами "лабильный" и "инертный". Если при комнатной температуре реакция комплекса протекает за время смешения реагентов (ок. 1 мин), комплекс относят к лабильным, если реакция протекает с измеримой скоростью и половина времени жизни комплекса более двух мин, такие комплексы наз. инертными. Например, константа скорости изотопного обмена молекул воды во внутр. координац. сфере для инертного комплекса [Ni(H2O)6]2+ равна 3,3∙104 с−1, а для лабильного [Cr(H2O)6]3+-5∙10−7 с−1. Устойчивость комплексов определяется природой центр. атома и лиганда и стерич. факторами. В соответствии с теорией "жестких" и "мягких" кислот и оснований все центр. атомы м. б. условно разделены на два класса: жесткие кислоты Льюиса и мягкие кислоты Льюиса. Первые имеют малый атомный или ионный радиус и высокую положит. степень окисления, предпочтительно взаимод. с неполяризующимися жесткими основаниями, такими как F−, OH−, NR−2. Кислоты второго класса имеют большой атомный или ионный радиус и низкую степень окисления, более эффективно взаимод. с легко поляризующимися мягкими лигандами, такими как SR2, PR3, I−, олефины. К жестким кислотам Льюиса относятся центр. ионы элементов в высших степенях окисления, с электронной конфигурацией do или d10. Мягкие кислоты Льюиса имеют электроны на d-орбиталях, способные к образованию p — связей в результате перекрывания с вакантными d-орбиталями мягких лигандов. Эти же центр. ионы образуют комплексы с олефинами типа соли Цейзе (формула XVI). Поскольку реакции комплексообразования подразумевают взаимод. кислот и оснований Льюиса, с увеличением основных свойств лигандов устойчивость комплексов повышается. Например, в рядах доноров R3PO более сильные по основности лиганды при введении в раствор полностью замещают более слабые во внутр. сфере
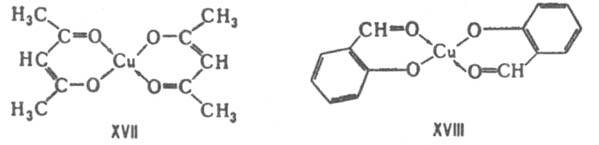
лабильных комплексов [M(OPR3)F5], где M-Nb(V), Ta(V). Комплексы хелатообразующих реагентов по сравнению с комплексами их монодентатных аналогов обладают повыш. устойчивостью (т. наз. хелатный эффект), напр. комплексы этилендиамина устойчивее, чем аммиака, причем устойчивость хелатного цикла зависит от числа атомов в нем. Для лигандов, сравнимых по основности, повышение двоесвязности в хелатном цикле приводит к повышению стабильности комплекса, напр. комплексы ацетилацетоната Cu (XVII) более стабильны, чем комплексы Cu с салициловым альдегидом (XVIII). Присоединение объемного заместителя к донорному атому или вблизи него, напр. замена атома Н на алкильную группу, приводит под влиянием стерич. факторов к уменьшению стабильности комплекса, напротив, введение алкильных групп в др. положения, вследствие увеличения основности лигандов, повышает стабильность комплексов. Стерич. эффекты благоприятствуют образованию транс-изомеров.
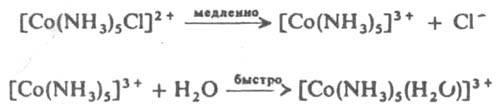
На стабильность комплексов оказывает влияние и природа донорного атома лигандов. В случае "жестких" центр. атомов уменьшение размера донорного атома лиганда и повышение его электронной плотности приводит к увеличению стабильности комплексов, что находится в соответствии с усилением координац. связи согласно электростатич. теории, напр. стабильность галогенидных или халькогенидных комплексов падает в рядах F>Cl>Br>I или О>S>Se~Те. В случае мягких центр. ионов наблюдается обратная тенденция: Fнаиб. устойчивы комплексы, образуемые при координировании мягким центр. атомом лигандов с мягкими донорными центрами (атомами) и жестким центр. атомом лигандов с жесткими донорными центрами. О влиянии лигандов друг на друга (цис-влияние, транс-влияние) см. лигандов взаимное влияние. Реакций К. с. 1. В реакциях замещения более основный лиганд замещает менее основный или одноименный, координированный центр. атомом. Эти реакции относятся к нуклеофильным реакциям. При диосоциативном SN1 механизме замещение протекает через медленную стадию диссоциации исходного комплекса с уменьшением к. ч. и послед. быстрой координацией входящей группы, напр.:
В случае октаэдрич. комплексов диссоциативный механизм SN1 предполагает образование пентакоординац. интермедиата (промежут. соед.) тетрагонально-пирамидального или тригонально-бипирамидального строения. В случае ассоциативного SN2 механизма замещение протекает через медленную стадию образования интермедиата с увеличением к. ч. центр. иона, как, напр.:
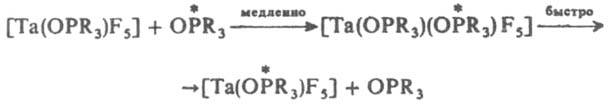
Для октаэдрич. комплексов полагают, что замещение по SN2 механизму может проходить с образованием гептакоординац. интермедиата в результате приближения входящей группы к положению, соседнему с положением уходящего лиганда (цис-атака), или к положению, противоположному положению уходящего лиганда (транс-атака):
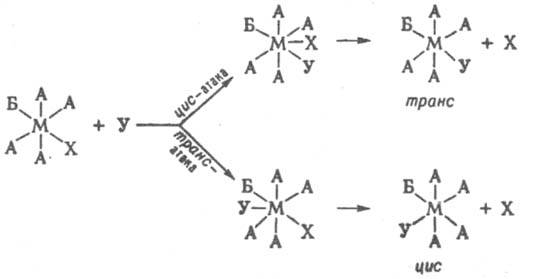
2. Реакции перераспределения лигандов — один из осн. методов синтеза разнолигандных комплексов. Они могут протекать между одноименными или разноименными центр. атомами, напр.:
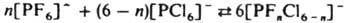
Наряду с механизмами SN1 и SN2, для этих реакций возможен четырехцентровый механизм, при котором два комплекса одновременно обмениваются лигандами:
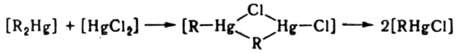
3. Реакции внутримол. обмена приводят к наблюдаемой спектроскопич. методами (напр., ЯМР) эквивалентности лигандов, занимающих стерически разл. положения во внутр. сфере К. с. Такие реакции могут идти без разрыва связей лигандов с центр. ионом. С высокой скоростью протекают они в К. с., имеющих строение тригональной бипирамиды. Один из возможных механизмов — псевдовращение, в соответствии с которым происходит парный обмен экваториальных и апикальных лигандов без разрыва связей:
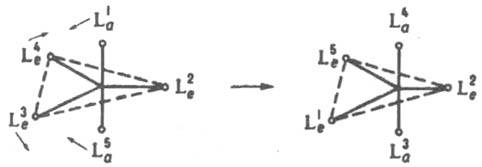
4. Реакции изомеризации комплексов с монодентатными лигандами, напр.:
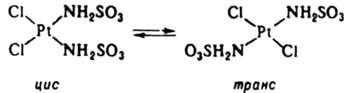
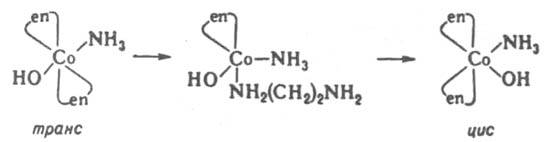
Такие реакции могут протекать как по механизму SN1, так и без разрыва связей лигандов с центр. ионом, особенно в случае тригонально-бипирамидальных комплексов. Изомеризация октаэдрич. К. с. происходит внутри- и межмолекулярно. В случае комплексов с хелатными лигандами изомеризация протекает по внутримол. механизму SN1 с размыканием хелатного цикла и уменьшением к. ч. в интермедиате:
5. Реакции координированных лигандов. а) Диссоциация лигандов — воды, спиртов, аминов и др., напр. обратимое превращение аквакомплексов в гидроксокомплексы:
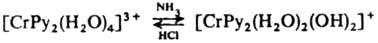
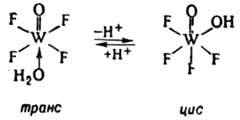
В результате диссоциации координир. молекулы воды происходит изменение характера связи атома О с центр. ионом, что может приводить к перестройке координац. сферы:
Диссоциация аква- и гидроксокомплексов может приводить к оляции — образованию полиядерных комплексов с мостиковыми атомами О или группами ОН:
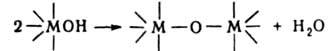
б) Окисление донорных атомов лигандов. Мягкие основания, напр. R3PS, R3PSe, R3PTe, во внутр. сфере жестких кислот Льюиса, напр. NbF5, TaF5, могут взаимод. с O2, в результате чего донорным становится более жесткий атом О:
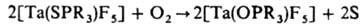
в) Изомеризация лигандов. Во внутр. сфере жестких кислот Льюиса основания мягкого типа, напр. зфиры монотиофосфиновых или монотиофосфорных кислот, могут изомеризоваться, в результате чего донорным становится более жесткий атом О и стабильность комплекса повышается:
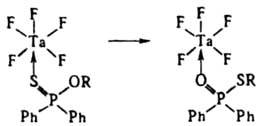
Скорость изомеризации падает с увеличением длины радикала R. г) Реакции присоединения и конденсации. В результате этих реакций из координир. лигандов образуются новые лиганды, напр.:
д) Реакции внедрения молекул типа CO, C2F4, SO2, CH3CN и т. д. в комплекс по связям лиганд — центр. ион приводят к образованию новых К. с., напр.:
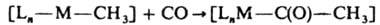
6. Окислит.-восстановит. реакции К. с. можно разделить на два типа: а) внешнесферные, в которых внутр. сфера не затрагивается и промежут. ассоциаты не образуются, напр.:
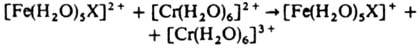
б) внутрисферные, в которых центр. атомы комплексов, участвующих в реакции, связываются мостиковым лигандом, напр.:
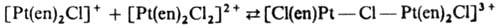
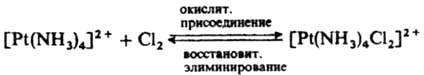
Для объяснения внешнесферного переноса электрона предложен туннельный механизм: перенос электрона может происходить на расстояниях, значительно больших, чем те, которые соответствуют столкновению комплексов. Если окислит. реакция сопровождается повышением к. ч., ее наз. окислит. присоединением, обратные реакции наз. восстановит. элиминированием:
Применение. Образование К. с. используют в экстракционных и сорбционных процессах разделения и тонкой очистки редких, цветных и благородных металлов, в аналит. химии (см. комплексонометрия, комплексоны). К. с. применяют в качестве селективных катализаторов разл. процессов хим. и микробиол. промышленности, для создания окислителей на основе фторидов галогенов и благородных газов, в качестве источников H2 и O2 на основе гидридов и кислородсодержащих соед., в медицине, в т. ч. в терапии разл. видов опухолей, в качестве источников микроэлементов в животноводстве и сельском хозяйстве, для получения тонких покрытий на разл. изделиях микроэлектроники и для придания антикоррозионных свойств и мех. прочности, и т. д. В живых организмах К. с. присутствуют в виде витаминов, комплексов некоторых металлов (в частности, Fe, Cu, Mg, Mn, Mo, Со) с белками и др. веществами.
• см. также аммины, ацидокомплексы, гетерополисоединения, карбонилы металлов и др. О π-комплексах см. металлоорганические соединения
Первое К. с. — хлорид гексаамминокобальта (III) — было открыто в 1798 Б. М. Тассером. Начало развития химии К. с. было положено почти спустя столетие, когда в 1893 А. Вернер дал объяснение образования таких соед. на основе созданной им координац. теории.
Лит.: Басоло Ф., Джонсон Р., Химия координационных соединений, пер. с англ., М., 1966; Басоло Ф., Пирсон Р., Механизмы неорганических реакций, пер. с англ., М., 1971; Гринберг А. А., Введение в химию комплексных соединений, 4 изд., Л., 1971; Макаше" Ю. А., Замяткина В. М., Соединения в квадратных скобках, Л., 1976; Кукушкин Ю. Н., Химия координационных соединений, М., 1985; Берсукер И. Б., Электронное строение и свойства координационных соединений, 3 изд.,.Л., 1986; Кукушкин Ю. Н., Реакционная способность координационных соединений. Л., 1987.
Ю. А. Буслаев, Е. Г. Ильин
Значения в других словарях
- КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ — КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ — то же, что комплексные соединения. Большой энциклопедический словарь
