аммины
АММИНЫ (аммиакаты, амминокомплексы) [от амм(иак)]
координационные соед., содержащие в качестве лигандов одну или неск. молекул NH3. Последнюю в роли лиганда наз. "аммин"; она связана с центр, атомом металла через атом N. Различают А. анионного типа (напр., K[PtCl3(NH3)]), катионного (напр., [Pt(NH3)4]Cl2) и комплексы-неэлектролиты (напр., [PtCl2(NH3)2]). В зависимости от числа молекул координированного NH3 А. часто подразделяют на моно-, ди-, три-, тетр-, пент- и гексаммины.
Для А. характерна внутрисферная амидореакция — отщепление протона от NH, под действием оснований, напр.:
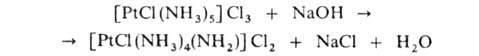
Под действием кислот или воды амидогруппа NH−2 снова превращается в NH3. Благодаря амидореакции А. обладают в водных растворах кислотными свойствами, напр. для [PtCl(NH3)5]Cl3 концентрационные константы кислотной диссоциации K1 и K2соотв. 7,9∙10−9 и 4,6∙10−11. Кислотные свойства А., как правило, в ряду комплексов с одинаковой геом. конфигурацией, с одним и тем же центр. атомом в одинаковых состояниях окисления усиливаются с ростом температуры и числа молекул NH3. При хлорировании А. могут образовываться комплексы с лигандами NH2C1, NHCl2, NC1−2., напр. [PtCl3(NH3)2NCl2]. А. часто являются восстановителями, участвуют в реакциях внутрисферного замещения молекул NH3 на др. лиганды. А. некоторых металлов, напр. Sc(III), легко гидролизуются с образованием гидроксокомплексов и ионов аммония.
А. обычно получают действием NH3 в водном растворе на простые или комплексные соли металлов, напр.:
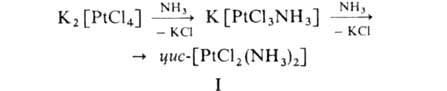
Они также образуются в результате присоединения газообразного NH3 к солям в отсутствие растворителя. Применяют А. для синтеза координационных соед. металлов, для обнаружения ряда ионов (напр., Cu2+), как лек. средства [напр., цис-дихлордиамминплатина (формула I) — противоопухолевый препарат]. Некоторые А. — промежут. продукты при получении металлов высокой степени чистоты (напр., спектрально чистой Pt), металлич. покрытий и пленок.
Ю. Я. Харитонов
