электрохимический ряд напряжений
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов (см. стандартный потенциал). Металлич. электроды в водном растворе электролита образуют след. Э. р. н.: Li, К, Rb, Ba, Sr, Ca, Na, Ce, Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au. Ддя сравнения включены водородный электрод (Pt, H2[l атм] | H+ ), потенциал которого при давлении водорода 1,01∙105 Па и термодинамич. активности а ионов H+ в водном растворе, равной 1, при всех температурах принимается равным нулю (потенциалопределяющая реакция H+ + е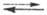 1/2H2, где е — электрон) и кислородный электрод (потенциалопределяющая реакция O2 + 2H2O + 4е
1/2H2, где е — электрон) и кислородный электрод (потенциалопределяющая реакция O2 + 2H2O + 4е 4OH−).
4OH−).
Э. р. н. позволяет судить о термодинамич. возможности протекания тех или иных электродных процессов. Металл с более отрицат. потенциалом может вытеснять металл с менее отрицат. потенциалом из растворов его солей, растворяясь при этом. Металлы, имеющие отрицат. стандартный потенциал по сравнению с водородным электродом (т. наз. электроотрицат. металлы), в растворах с не слишком большой термодинамич. активностью ионов металла имеют более отрицат. потенциал, чем водородный электрод в сильно кислых растворах. Поэтому при замыкании такого электрода с водородным между ними протекает ток, металл растворяется, а на водородном электроде выделяется водород (см. анодное растворение). Электроотрицат. металлы термодинамически неустойчивы в водных растворах (их наз. неблагородными металлами) и осаждаются на катоде при более отрицат. потенциале, чем потенциал выделения H2 (см. электроосаждение).
Металлы, потенциал которых менее положительный, чем у кислородного электрода, термодинамически неустойчивы в контакте с O2 (или воздухом) и водой. Поэтому Э. р. н. служит для ориентировочных оценок скорости электрохим. коррозии в водных растворах при обычных температурах, а также для выбора безопасных контактных пар (гальванич. пар) разнородных металлов. Если металл электроотрицательнее, чем H2, то может идти активный коррозионный процесс (см. коррозия металлов, коррозионностойкие материалы, электрохимическая защита). Практич. реализация электродных процессов определяется наряду с термодинамич. также и кинетич. факторами (см. электрохимическая кинетика).
Положение в Э. р. н. металлов, образующих ионы разного заряда, зависит от природы соответствующих ионов. Аналогичные ряды напряжений можно построить для неметаллич. и редокс-электродов (окислит.-восстановительных).
О. А. Петрий
