стандартный потенциал
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал)
значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно С. п. находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей реакции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01∙105 Па (1 атм). Для водных растворов в качестве стандартного электрода используют водородный электрод (Pt; H2 [1,01∙105Па], H+ [a=1]), потенциал которого при всех температурах принимается равным нулю (см. электроды сравнения): С. п. равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схе-матич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутся электроны, а в растворе — положительно заряженные частицы. Например, С. п. хлорсеребряного электрода равен эдс гальванич. ячейки
-Pt, H2[1,01∙105Па]|HCl(аb=l)|AgCl, Ag|Pt +
Для любой электродной реакции, включающей перенос n электронов, электродный потенциал определяется уравнением:
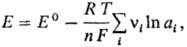
где Е°-С. п. электрода, R-газовая постоянная, Т — абс. температура, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной реакции, vi-стехиометрич. коэффициенты (положит. числа для продуктов реакций и отрицат. числа для исходных веществ, если при записи стехиометрич. уравнения электрохим. процесса электроны входят в левую часть уравнения, напр. AgCl + е : Ag + С1−). Значения С. п. для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. С. п. металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
С. п. определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. растворы, либо расчетом — по данным о стандартных значениях изменения энергии Гиббса хим. реакции ΔG0. В последнем случае реакцию представляют в виде суммы двух (или более) электродных реакций, одна из которых — окис-лит.-восстановит. реакция с искомым С. п. 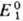 , а другая — с известным С. п. .
, а другая — с известным С. п. .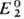 . Если в условной схеме ячейки 1-й электрод записан слева, то
. Если в условной схеме ячейки 1-й электрод записан слева, то
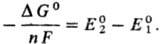

Из уравнения следует, что С. п., в свою очередь, м. б. использованы для расчета ΔG0 и константы равновесия К реакции (ln К = — ΔG°/RT). Значения E0, рассчитанные на основе значений ΔG0, представлены в таблице; они далеко не всегда м. б. реализованы в электрохим. цепях из-за того, что предполагаемое равновесие электродной реакции в действительности может не устанавливаться (это характерно для щелочных, щел.-зем. металлов и большинства орг. веществ в водных растворах).
В неводных растворителях С. п. также определяют по отношению к потенциалу водородного электрода для каждого отдельного растворителя. Ведется поиск стандартного электрода, потенциал которого можно было бы считать практически не зависящим от природы растворителя, что позволило бы создать единую шкалу электродных потенциалов. В качестве таких электродов предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/ /бис(дифенил)хром(0), потенциалы которых из-за большого размера ионов и соотв. малой их сольватации незначительно (по сравнению с потенциалом водородного электрода) зависят от природы растворителя. Последние два электрода рекомендованы в 1984 ИЮПАК в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения и стандартного состояния исследуемого электрода в системах с расплавами и твердым электролитом в большой мере определяется природой как исследуемого электродного процесса, так и ионного проводника. В широко используемых в качестве электролитов расплавах хлоридов металлов С. п. берется в хлорной шкале, т. е. в качестве стандартного пользуются хлорным электродом в расплавленном хлориде (графит, Cl2 [1,01∙105 Па], MC1z [расплав]), где М-металл (на практике обычно берут смесь хлоридов металла). Активность катионов Мz+ в индивидуальном расплаве принимается равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый (Pt; Fe, FeO).
Лит.: Электрохимия металлов в неводных растворах, пер. с англ., М., 1974; Методы измерения в электрохимии, т. 1, пер. с англ., М., 1977; Шаталов А. Я., Введение в электрохимическую термодинамику, М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Standard Potentials in aqueous solution, ed. by A.J. Bard, N.Y.-Basel, 1985.
Б. И. Подловченко
Значения в других словарях
- Стандартный потенциал — То же что Нормальный потенциал. Большая советская энциклопедия
