циклооктатетраен
ЦИКЛООКТАТЕТРАЕН (формула I)
мол. м. 104,14; золотисто-желтая жидкость; т. пл. −7 °C, т. кип. 142 °C, 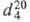 0,9206;
0,9206; 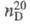 1,5375;
1,5375; 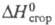 −4475,7 кДж/моль;
−4475,7 кДж/моль; 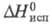 43,12 кДж/моль. Длины связей в молекуле (нм): С = С 0,13, C—C 0,146, C—H 0,109, углы С = C—H 118,3°, С = C—C 126,46°.
43,12 кДж/моль. Длины связей в молекуле (нм): С = С 0,13, C—C 0,146, C—H 0,109, углы С = C—H 118,3°, С = C—C 126,46°.
Ц. проявляет свойства ненасыщ. соед.: легко присоединяет водород, галогены, окисляется.
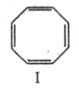
Гидрирование приводит к продуктам частичного или полного восстановления; реакцию используют в синтезе пробковой кислоты:
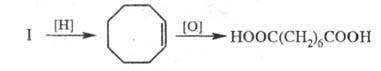
При хлорировании Ц. при температуре от −30 до 0 °C образуется гл. обр. 2,3,4,5,7,8-гексахлорбицикло[4.2.0]октан, а при действии SO2C12 — 7,8-дихлорбицикло[4.2.0]окта-2,4-диен; последний при гидрировании превращается в бицикло[4.2.0]октан:
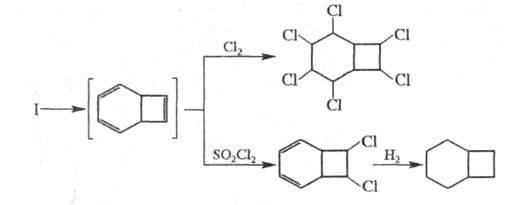
Надкислоты окисляют Ц. до эпоксида, при гидрировании которого образуется циклооктанол:
Окисление Ц. гипохлоритами в щелочной среде приводит к терефталевому альдегиду, хромовым ангидридом в уксусной кислоте — к терефгалевой кислоте.
При длительном кипячении в атмосфере азота Ц. димери-зуется по схеме диенового синтеза, в более жестких условиях — полимеризуется.
Получают Ц. тетрамеризацией ацетилена в присутствии солей Ni при 50–60 °C под давлением в среде ТГФ.
Применяют Ц. для получения циклооктана, циклооктена и др. соед. этого ряда.
Лит.: Химия ацетилена. Сб., пер. с англ. и нем., М., 1954; Schroder G., Cyclooctatetraen, Weinheim, 1965.
Э. Е. Нифантьев
