термохимия
ТЕРМОХИМИЯ
раздел химической термодинамики, включающий определение теплового эффекта реакции и установление его зависимости от физ.-хим. параметров. В задачу Т. входит также измерение и вычисление теплот фазовых переходов, растворения, разбавления и др. процессов, изучение теплоемкостей, энтальпий и энтропии веществ. Осн. эксперим. метод Т.-калориметрия. Иногда используют некалоримет-рич. методы (расчет тепловых эффектов из результатов измерения констант равновесия, эдс и т. п.), однако в этих случаях результаты обычно менее точны.
Т. возникла в сер. 18 в. На необходимость измерения тепловых эффектов реакций и теплоемкостей указывал еще М. В. Ломоносов; первые термохим. измерения провели Дж. Блэк, А. Лавуазье, П. Лаплас. Развитие Т. в 19 в. тесно связано с именами Г.И. Гесса, М. Бертло, X.Томсена. Гесса закон, открытый в 1840, дает возможность определять тепловые эффекты хим. реакций расчетным путем, в частности по теплотам образования исходных веществ и продуктов. Тем самым открывается путь для расчета таких тепловых эффектов, прямое измерение которых затруднительно, а иногда невозможно. Необходимые для расчета стандартные теплоты образования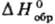 собраны в фундам. термодинамич. справочники.
собраны в фундам. термодинамич. справочники.
В сер. 19 в. Томсен и Бертло высказали идею, согласно которой хим. реакции, происходящие без подвода энергии извне, протекают в направлении макс. выделения теплоты (принцип Бертло-Томсена). Ими и их учениками были разработаны осн. эксперим. методики Т. и измерены тепловые эффекты мн. реакций. В России в кон. 19 в. такие измерения проводил В. Ф. Лугинин, основавший термохим. лабораторию. Хотя в общем виде принцип Бертло-Томсена оказался неверен, за Т. сохранилась ведущая роль в исследовании возможности протекания хим. реакций в заданых условиях. Так, уравнение
ΔH-TΔS = -RTlnКр,
являющееся обобщением первого и второго начал термодинамики (ΔH-изменение энтальпии, ΔS-изменение энтропии при хим. реакции, Т — температура, R-газовая постоянная), позволяет рассчитать константу равновесия Кр любой реакции через тепловые величины. В настоящее время можно говорить о полном слиянии Т. с хим. термодинамикой, т. к., с одной стороны, для характеристики веществ и хим. процессов наряду с тепловыми эффектами необходимо знать и др. термодинамич. функции, а с др. стороны-расчет тепловых эффектов можно производить с помощью термодинамич. зависимостей, напр. по приведенному выше уравнению или из температурной зависимости Кр (см. Кирхгофа уравнение).
В 20 в. совершенствование методов термохим. измерений привело к резкому повышению их точности. Один из наиб. часто применяемых эксперим. приемов-определение энтальпий сгорания веществ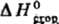 в калориметрич. бомбе в сжатом кислороде (до 3 МПа); введен в практику Бертло, модифицирован для определения энтальпий образования наиб. важных неорг. веществ (оксидов, гидридов и т. п.) и
в калориметрич. бомбе в сжатом кислороде (до 3 МПа); введен в практику Бертло, модифицирован для определения энтальпий образования наиб. важных неорг. веществ (оксидов, гидридов и т. п.) и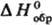 стал основным при изучении термохим. свойств орг. соединений. Значения
стал основным при изучении термохим. свойств орг. соединений. Значения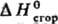 галогенорг., сераорг. и некоторых др. веществ определяют в калориметрах с вращающимися бомбами. Точность определения
галогенорг., сераорг. и некоторых др. веществ определяют в калориметрах с вращающимися бомбами. Точность определения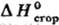 орг. веществ !0,01%. Теоретич. обработка опытных данных для орг. соед. заключается прежде всего в установлении связи между величинами
орг. веществ !0,01%. Теоретич. обработка опытных данных для орг. соед. заключается прежде всего в установлении связи между величинами 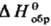 или
или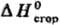 и строением молекул. Развиты методы определения
и строением молекул. Развиты методы определения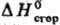 неорг. веществ во фторе (фторная калориметрия), хлоре, определение теплот гидрирования. Для осуществления таких реакций исходные вещества в калориметрич. бомбе часто приходится нагревать до высоких температур (иногда до 1000–1300 °C). Др. универсальный метод Т. — определение теплот растворения веществ в воде или теплот реакций с водными растворами кислот, щелочей и т. п. Эти данные позволяют включить в термохим. циклы большой круг веществ и рассчитать для них
неорг. веществ во фторе (фторная калориметрия), хлоре, определение теплот гидрирования. Для осуществления таких реакций исходные вещества в калориметрич. бомбе часто приходится нагревать до высоких температур (иногда до 1000–1300 °C). Др. универсальный метод Т. — определение теплот растворения веществ в воде или теплот реакций с водными растворами кислот, щелочей и т. п. Эти данные позволяют включить в термохим. циклы большой круг веществ и рассчитать для них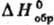 или определить теплоты неизученных реакций. Определение теплоемкости жидкостей и растворов, теплот растворения, смешения и испарения, а также их зависимости от температуры и концентрации имеют самостоят. значение как эксперим. основа для разработки теории жидкого состояния (см. жидкость). Большой интерес для практики представляют теплоты растворения электролитов в неводных и смешанных растворителях. Для исследования тугоплавких и труднорастворимых в воде соед. во 2-й пол. 20 в. развит метод, основанный на определении теплоты растворения в расплавл. смеси оксидов (2PbO + В2O3 или 9PbO + 3CdO + 4В2O3).
или определить теплоты неизученных реакций. Определение теплоемкости жидкостей и растворов, теплот растворения, смешения и испарения, а также их зависимости от температуры и концентрации имеют самостоят. значение как эксперим. основа для разработки теории жидкого состояния (см. жидкость). Большой интерес для практики представляют теплоты растворения электролитов в неводных и смешанных растворителях. Для исследования тугоплавких и труднорастворимых в воде соед. во 2-й пол. 20 в. развит метод, основанный на определении теплоты растворения в расплавл. смеси оксидов (2PbO + В2O3 или 9PbO + 3CdO + 4В2O3).
Современная Т. включает производство прецизионной калориметрич. аппаратуры. Выпускаемые серийно в ряде стран микрокалориметры отличаются высокой чувствительностью, практически неограниченной продолжительностью измерений и широко применяются при определении небольших тепловых эффектов и теплот медленных реакций, недоступных ранее для прямого термохим. изучения (гидролиз сложных эфиров, этерификация, гидратация оксидов, твердение цемента и др.). Развитие микрокалориметрии открыло возможности для термохим. изучения биохим. процессов и превращений макромолекул. Изучаются тепловые эффекты, сопровождающие ферментативные реакции, фотосинтез, размножение бактерий и др. Дифференциальные сканирующие калориметры позволяют ускорить и упростить измерение теплоемкостей и теплот фазовых переходов по сравнению с классич. приборами, действующими на принципе периодич. ввода энергии.
Несмотря на совершенствование измерит. техники, термохим. эксперимент остается трудоемким, поэтому наряду с прямым определением термич. величин в Т. широко применяют расчетные методы. Чаще всего используют эм-пирич. методы, базирующиеся на установленных термохим. закономерностях. В Т. орг. соединений обычно ΔHобр вычисляют по аддитивным феноменологич. схемам, как суммы вкладов от структурных фрагментов молекулы, определяемых на основе наиб. надежных эксперим. данных.
Квантовая химия совместно со статистич. термодинамикой позволяет вычислять энергии и энтальпии образования хим. соед., однако пока, как правило, лишь для сравнительно простых систем. Методы молекулярной механики также м. б. использованы для расчета термохим. величин некоторых классов соединении. Эти методы используют довольно большое число молекулярных параметров и, как правило, требуют корреляции с надежными термохим. данными, полученными эксперим. путем. Таким образом, эксперим. методы остаются в Т. до сих пор основными, что способствует дальнейшему расширению исследований и совершенствованию эксперим. техники.
Главные направления эксперим. исследований в современной Т. заключаются в надежном установлении т. наз. ключевых термохим. величин, на которых основаны дальнейшие расчеты, а также в изучении новых и малоизученных классов соед. — полупроводников, комплексных соед., орг. соединений бора, фтора, кремния, фосфора, серы и др. Интенсивно изучают высокотемпературные сверхпроводники, соед. РЗЭ. Возрастает применение Т. в исследовании поверхностных явлений, др. областей коллоидной химии, радиохим. процессов, химии полимеров, своб. радикалов и т. п. Термохим. величины используют для установления связи между энергетич. характеристиками хим. соед. и его строением, устойчивостью и реакционной способностью; в качестве базовых термодинамич. данных при проектировании и усовершенствовании хим. производств (в частности, для расчета макс. выхода продукта и прогнозирования оптимального режима); для составления энергетич. баланса хим. реакторов в технол. процессах, исследования и прогнозирования энергоемких структур при создании новых видов топлива.
Лит.: Кальве Э., Прат А., Микрокалориметрия, пер. с франц., М., 1963; Скуратов С. М., Колесов В.П., Воробьев А.Ф., Термохимия, ч. 1–2, М., 1964 66; МищенкоК.П., Полторацкий Г.М., Вопросы термодинамики и строения водных и неводных растворов электролитов, Л., 1968; Леони-дов В.Я., Медведев В.А., Фторная калориметрия, М., 1978; Бенсон С, Термохимическая кинетика, пер. с англ., М., 1971; Experimental thermochemistry, ed. by F.D. Rossini, H.A. Skinner. v. 1–2, N. Y.-L., 1956–62; Cox J. D., Pilcher G., Thermochemistry. of organic and orgranometallic compounds, L.-N.Y., 1970; Ped1eу J. В., Naу1оr R. D., Кirbу S. P., Thermochemical data of organic compounds, 2 ed., L.-N.Y., 1986; Codata key values for thermodynamics, ed. by J.D. Cox, N.Y., 1989.
В. П. Колесов
Значения в других словарях
- Термохимия — Раздел физической химии (См. Физическая химия) вообще и термодинамики химической (См. Термодинамика химическая) в частности, включающий измерение и вычисление тепловых эффектов реакций (См. Тепловой эффект реакции), теплот фазовых переходов (См. Большая советская энциклопедия
- термохимия — орф. термохимия, -и Орфографический словарь Лопатина
- термохимия — Терм/о/хи́м/и/я [й/а]. Морфемно-орфографический словарь
- ТЕРМОХИМИЯ — ТЕРМОХИМИЯ, раздел физической химии, изучающий ТЕПЛОВЫЕ эффекты, сопровождающие химические процессы. Примером служит выделение или поглощение тепла при химической реакции, растворении вещества или изменении агрегатного состояния, например, при переходе жидкости в газ. Научно-технический словарь
- Термохимия — Отдел химии, занимающийся превращениями внутренней энергии тел в тепло при химических процессах. Почти каждая химическая реакция связана с тем или иным тепловым эффектом: химическое превращение сопровождается или выделением, или поглощением тепла. Энциклопедический словарь Брокгауза и Ефрона
- термохимия — Термохимии, мн. нет, ж. [от греч. therme – теплота и слова химия] (хим.). Отдел химии, изучающий тепловые явления в химических процессах. Большой словарь иностранных слов
- ТЕРМОХИМИЯ — ТЕРМОХИМИЯ — изучает тепловые явления, сопровождающие химические реакции. Термохимические данные (теплоты образования и сгорания химических соединений, тепловые эффекты реакций и др.) используют в химической технологии, напр., при расчетах тепловых балансов процессов. Большой энциклопедический словарь
- термохимия — термохимия ж. Раздел физической химии, занимающийся изучением тепловых явлений, сопровождающих химические процессы. Толковый словарь Ефремовой
- термохимия — ТЕРМОХ’ИМИЯ, термохимии, мн. нет, ·жен. (от ·греч. therme — теплота и слова химия) (·хим. ). Отдел химии, изучающий тепловые явления в химических процессах. Толковый словарь Ушакова
