твердые растворы
ТВЕРДЫЕ РАСТВОРЫ
однородные (гомогенные) крис-таллич. фазы переменного состава; образуются в двойных или многокомпонентных системах. Если компоненты системы неограниченно растворимы друг в друге, они образуют непрерывный ряд Т. р. Чаще, однако, концентрация растворенного вещества не может превышать некоторое предельное значение и существование Т. р. ограничено некоторыми областями составов (области гомогенности). Т. р. являются мн. метал-лич. сплавы и неметаллич. системы — минералы, стекла, полупроводники, ферриты.
Типы диаграмм состояния. На диаграмме состояния двойных систем в координатах температура-состав образованию непрерывных Т. р. отвечают три типа линий ликвидуса и солидуса (рис. 1, а, б и в), отграничивающих области существования жидкой фазы (расплава) и Т. р. (Ж и α соотв.) и область сосуществования обеих фаз (Ж + α). Тип б встречается крайне редко, гл. обр. в случае оптич. изомеров орг. веществ. В системах с непрерывными Т. р., согласно принципу соответствия (см. физико-химический анализ), должна быть только одна кривая ликвидуса и одна кривая солидуса. Поэтому в точке минимума или максимума происходит плавный переход одной части кривой в другую.
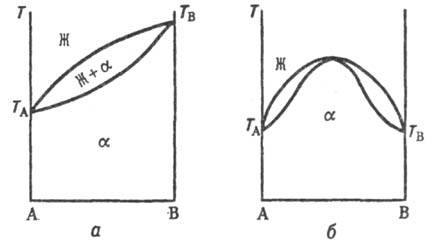
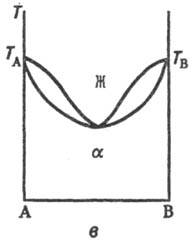
Рис. 1. Диаграммы состояний двойных систем в координатах температура Т-состав А-В: Ж-жидкая фаза (расплав), α-непрерывный твердый раствор, ТА и TB-температуры плавления чистых компонентов.
Если компоненты образуют только ограниченные Т. р., возможны два типа диаграмм состояния (рис. 2), на которых Т. р. компонента А в В, обозначаемые как α-p-p, образуются лишь до определенной концентрации В, а Т. р. В в А (раствор-р)-до определенной концентрации А. В первом случае Т.р. образуют эвтектику, т. е. существует точка E нонва-риантного равновесия трех фаз: жидкого расплава, состав которого отвечает точке E, твердого α-раствора, концентрация которого соответствует точке F, и твердого β-p-pa, концентрация которого отвечает точке G, причем точка E лежит между точками состава этих Т. р. Ниже температуры ТЕ остаются в равновесии два Т. р. α и β, составы которых по мере снижения температуры изменяются в соответствии с ходом линий GM и FN (рис. 2, а). Образование подобных Т. р. наблюдается, напр., в системах Cu-Ag, Pb-Sn. Во втором случае Т. р. Образуют перитектику-нонвариантную точку также трехфазного равновесия, но расположенную по одну сторону от точек состава Т. р. (точка Р, рис. 2,б). Примером системы пе-ритектич. типа может служить Cd-Hg.
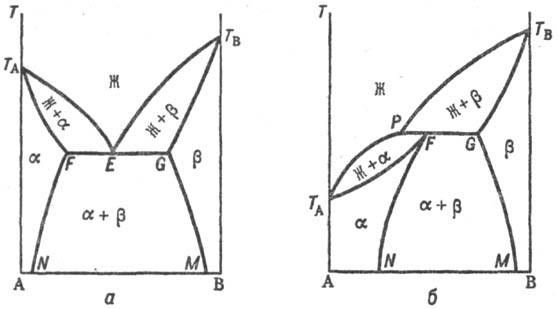
Рис. 2. Диаграммы состояния двойных систем с ограниченными по составу твердыми растворами α и β: а — система с эвтектич. точкой Е; б-система с пери-тектич. точкой Р. Остальные обозначения те же, что и на рис.'1.
На линиях ликвидуса ограниченных Т. р. иногда встречаются экстремальные точки-минимум или (чаще) максимум. Последнее характерно для солевых и оксидных систем только в случае гетеровалентных Т. р. (см. ниже) с переменным числом ионов в элементарной ячейке, напр. Т. р. Y2O3 в ZrO2. Повышение температуры плавления при образовании такого Т. р., напр. DyF3 в PbF2, м. б. настолько сильным, что температура плавления эвтектич. смеси (957 °C) становится выше температуры плавления компонента (для PbF2 824 °C).
Распад Т. р. Предельная концентрация Т. р. зависит от температуры и давления. При понижении температуры взаимная растворимость компонентов, как правило, понижается. Влияние давления неоднозначно, для большинства систем повышение давления приводит к уменьшению взаимной растворимости.
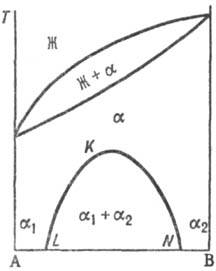
Рис. 3. Распад непрерывного твердого раствора с образованием двухфазной системы. Жирная линия — бинодаль, отделяющая область существования твердого раствора от области сущестзования двухфазной системы.
При охлаждении однородного раствора ниже критич. температуры растворимости (смешения) (точка К) образуется двухфазная система, состоящая из несмешивающихся Т. p. α1 и α2 (рис. 3), составы которых изменяются с температурой по линиям KL и KN соответственно. Др. тип распада Т. р. α наблюдается, если компоненты А и В могут образовать хим. соед. АmВn (рис. 4), характеризующееся упорядоченным расположением частиц (атомов или ионов) в кристаллической решетке, в отличие от статистического беспорядка в расположении частиц, характерного для Т. р. На основе АmВn образуется Т. р. β с компонентами А и В. Превращение в упорядоченную фазу (сегрегация) может происходить как фазовый переход II рода. При этом выше температуры перехода вероятности заполнения к.-л. кристаллографич. позиции разл. атомами (ионами) равны, а ниже точки перехода различаются.
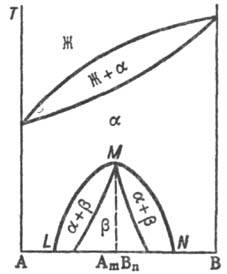
Рис. 4. Распад непрерывного твердого раствора с образованием хим. соед. АmВn. Жирная линия — температура начала кристаллизации твердого раствора β на основе АmВn.
Полиморфизм. С полиморфным превращением вещества, на основе которого образуется Т. р;, всегда связано и превращение Т. р. На рис. 5 приведены диаграммы состояния систем с наиб. часто встречающимися вариантами полиморфного превращения. При эвтектоидном превращении (рис. 5, а) т-pa трехфазного равновесия (точка E') T. р. α и β, образующихся на основе двух модификаций компонента А, с Т. р. γ на основе компонента В расположена ниже температуры Тн полиморфного превращения, а область гомогенности Т. р. на основе низкотемпературной модификации (β) уже, чем на основе высокотемпературной (α); при перитектоидном (рис. 5, б)-наоборот.
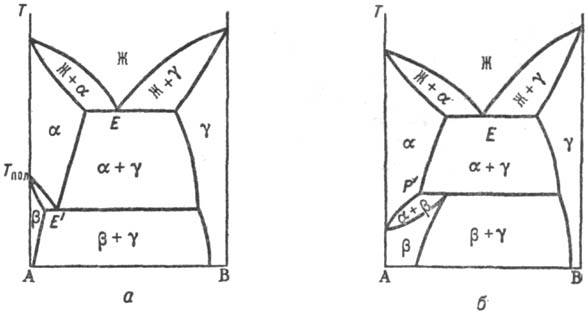
Рис. 5. Диаграммы состояния двойных систем с полиморфным превращением твердого раствора по эвтектоидному типу (а) и по перитеггоидному типу (б).
Типы Т.р. В Т.р. замещения растворенное вещество замещает исходное-атом на атом, ион на ион или молекула на молекулу. При этом число частиц (атомов, молекул) в элементарной кристаллич. ячейке остается постоянным. Один из важнейших факторов, определяющих возможность образования Т. р. замещения,-это размеры замещающих друг друга атомов (ионов, молекул). Согласно правилу Гольдшмидта, для образования широких по составу областей гомогенности Т. р. при температурах, далеких от температур плавления компонентов, разница Δr в ионных радиусах замещающих друг друга ионов не должна превышать 15%, т. е. отношение Δr/r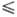 15% (r-меньший радиус). Аналогичное правило 15%-ного различия атомных диаметров для Т. р. металлов и ковалентных веществ было установлено В. Юм-Розери (1934). В настоящее время чаще используется др. размерный фактор-межатомное расстояние R. Для хим. соединения с преим. ионной связью непрерывные Т. р. замещения образуются при всех температурах, если ΔR/R < 4 — 5% (А. С. Поваренных, 1964). Если ΔR/R лежит в пределах от 15 до 20–25%, то даже при высоких температурах образуются только ограниченные Т. р., а при ΔR/R > 20–25% заметное взаимное растворение отсутствует. Используют и др. размерные факторы: параметры кристаллич. решетки, молярные объемы и т. п. При этом роль размерных факторов зависит от типа хим. связи. Чем сложнее хим. соед., тем, как правило, шире области гомогенности Т. р. замещения. В случае молекулярных кристаллов, в частности органических, возможность образования Т. р. замещения определяется не только размером, но и конфигурацией молекул.
15% (r-меньший радиус). Аналогичное правило 15%-ного различия атомных диаметров для Т. р. металлов и ковалентных веществ было установлено В. Юм-Розери (1934). В настоящее время чаще используется др. размерный фактор-межатомное расстояние R. Для хим. соединения с преим. ионной связью непрерывные Т. р. замещения образуются при всех температурах, если ΔR/R < 4 — 5% (А. С. Поваренных, 1964). Если ΔR/R лежит в пределах от 15 до 20–25%, то даже при высоких температурах образуются только ограниченные Т. р., а при ΔR/R > 20–25% заметное взаимное растворение отсутствует. Используют и др. размерные факторы: параметры кристаллич. решетки, молярные объемы и т. п. При этом роль размерных факторов зависит от типа хим. связи. Чем сложнее хим. соед., тем, как правило, шире области гомогенности Т. р. замещения. В случае молекулярных кристаллов, в частности органических, возможность образования Т. р. замещения определяется не только размером, но и конфигурацией молекул.
Размерный фактор не всегда является решающим. Например, NaCl и PbS не образуют Т. р., хотя их размерные факторы (радиусы ионов, межатомные расстояния и др.) близки. Второй необходимый фактор-хим. подобие компонентов, в частности близость типа хим. связи. В качестве параметра, определяющего возможность образования Т. р. замещения, используют различие в степени ионности связи, иногда — разность электроотрицательностей атомов замещающих друг друга элементов. Предложено использовать в качестве характеристик хим. подобия температуры плавления хим. соед. или энергии 17 кристаллич. решеток. Для образования непрерывных Т. р. замещения требуется, чтобы ΔTпл/Tпл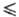 27%, ΔU/U < 10%. В случае мол. кристаллов важное значение имеет наличие у обоих компонентов водородных связей, а также существование у молекул собств. дипольного момента. В частности, практически неизвестны Т. р. на основе льда, т. к. нет подобных ему веществ по указанным характеристикам.
27%, ΔU/U < 10%. В случае мол. кристаллов важное значение имеет наличие у обоих компонентов водородных связей, а также существование у молекул собств. дипольного момента. В частности, практически неизвестны Т. р. на основе льда, т. к. нет подобных ему веществ по указанным характеристикам.
В Т.р. внедрения атомы (молекулы) растворенного вещества располагаются в междоузлиях кристаллич. решетки, образованной веществом-основой Т. р., или в стехиометрич. вакансиях. В результате число атомов (молекул) в элементарной ячейке кристалла увеличивается. Классич. пример Т. р. внедрения-растворы неметаллов H, N, С, О в металлах. В Т. р. на основе In2Те3, обладающего дефектной структурой типа сфалерита, примесные атомы Sb, Bi, In и др. располагаются в стехиометрич. вакансиях. Т. р. внедрения являются растворы воды в цеолитах-молекулы воды располагаются в полостях структуры осн. вещества. При образовании Т. р. внедрения не требуется близости типа хим. связи, а размерный фактор может играть роль, противоположную Т. р. замещения, а именно: макс. взаимной растворимости компонентов благоприятствует наиб. разница их атомных радиусов.
В Т.р. вычитания число атомов в элементарной ячейке кристалла уменьшается по сравнению с чистым компонентом. Такие Т. р. часто образуются на основе нестехиомет-рич. соединении. Так, в сульфиде железа Fe1-xS, который можно рассматривать как Т. p. S в FeS, в действительности имеются своб. октаэдрич. пустоты — катионные вакансии-вследствие того, что часть атомов железа имеет степень окисления III. Т. р. калия в KCl-также Т. р. вычитания. В его решетке существуют анионные вакансии, в которых локализуются электроны, что обеспечивает электрич. нейтральность кристаллич. решетки. В пределах области гомогенности одной и той же фазы могут наблюдаться как Т. р. внедрения, так и Т. р. вычитания, поэтому иногда эти типы Т. р. объединяют под назв. "Т. р. с переменным числом атомов в элементарной ячейке".
Т. р. как внедрения, так и замещения м. б. неупорядоченными-со статистич. распределением атомов в решетке либо частично или полностью упорядоченными, с определенным расположением атомов разного сорта относительно друг друга. Упорядоченные Т.р. иногда наз. сверхструктурами. В некоторых случаях в Т. р. атомы одного сорта могут образовывать скопления, которые, в свою очередь, могут определенным образом упорядочиваться или ориентироваться в данном направлении. Таким образом, Т. р., будучи истинно гомогенным в макроскопич. масштабе, т. е. система, находящаяся в термодинамич. равновесии, м. б. неоднородной при рассмотрении на микроуровне. Эксперим. данные об упорядочении Т. р. получают в осн. при использовании рентгеновского структурного анализа. Упорядоченность Т. р. и ее изменения в процессах старения важны для материаловедения (см. сплавы).
Гетеровалентные Т. р. образуются хим. соединениями, включающими катионы или анионы в разных степенях окисления. Механизм образования таких Т. р. может быть различным. Это могут быть Т. р. замещения, если происходит одновременное замещение двух видов атомов или ионов (двойное замещение). Так, в полевых шпатах (плагиоклазах) Т. р. образуется в результате замещения пары Na+ + Si4+ на пару Ca2+ + Al3+. В сиалонах (Si3_xAlx)(N4_xOx) -Т. р. на основе β-нитрида кремния — происходит одновременная замена Si на Al и N на О. Возможны гетеровалентные Т. р. замещения и вычитания. Так, в Т. p. AgCl и CdCl2 замещение иона Ag+ на Cd2+ сопровождается образованием катионной вакансии. При растворении CaO в кубич. модификации ZrO2 замещение катионов Zr4+ на Ca2+ сопровождается образованием кислородной вакансии. Замещение может сопровождаться внедрением в кристаллич. решетку дополнит. катионов или анионов. Так, фториды щел.-зем. металлов растворяют фториды РЗЭ; при этом дополнит. анионы F располагаются в октаэдрических междоузлиях структуры флюорита. В щелочных бериллах часть атомов Be замещается Li, одновременно дополнит. катионы Na или Cs располагаются внутри каналов из силикатных колец Si6O18. При образовании гетеровалентных Т. р. с изменением числа атомов в элементарной кристаллич. ячейке оптим. размер иона-заместителя не совпадает с размером замещаемого иона. А.Е.Ферсман (1933) полагал, что наиболее благоприятна для образования Т. р. ситуация, когда ион-заместитель, несущий больший электрический заряд, имеет и больший радиус. Однако часто, напр. при образовании Т. р. сульфатов двухвалентных металлов в сульфатах Na или К, наблюдается обратная зависимость. Вообще размерный фактор иногда очень сильно, а иногда относительно слабо влияет на ширину областей гомогенности таких Т. р., в зависимости от природы соединения-основы.
Некоторые гетеровалентные Т. р. (напр., KClO4 в BaSO4 или KBF4 в SrSO4) относятся к числу т. наз. аномальных Т. р., в которых наблюдается ниж. температурный предел смешения или при понижении концентрации коэф. сокрис-таллизации стремится к 0 (см. соосаждение). Это объясняется замещением отдельных блоков элементарных ячеек, так что образуется не истинный, а микродисперсный ("коллоидный") Т. р.
Выяснение механизма образования Т. р. требует применения физ. методов исследования, в частности рентгеновского структурного анализа. К числу наиб. часто применяемых методов исследования Т. р. относится рентгенография порошков. Параметры кристаллич. решетки Т. р. линейно зависят от состава (Л. Вегард, 1921); реально наблюдаются отклонения от этого правила. Широко используют также измерения плотности; согласно правилу Ретгерса (1889), плотность, а также молярный объем аддитивно зависят от концентрации. Измерение температур фазовых переходов (см. термография) позволяет строить диаграммы растворимости с их последующим физико-химическим анализом.
Для Т. р., как и для жидких растворов, применяют термодинамические модели и рассматривают идеальные Т. р., в которых энтальпия смешения равна нулю, регулярные, субрегулярные Т. р. (см. растворы неэлектролитов).
Природные кристаллич. вещества (минералы) и синтетич. кристаллы представляют собой многокомпонентные Т. р.; даже вещества высокой чистоты с очень малым содержанием примесей являются Т. р. Как было показано Н. С. Курна-ковым и С.Ф.Жемчужным (1906), свойства Т.р. отличаются (иногда очень сильно) от свойств чистых компонентов. В частности, при образовании Т. р. на основе металла возрастает твердость и уменьшается электропроводность вещества. Изменение состава Т. р. позволяет изменять в широких пределах свойства сплавов, полупроводниковых материалов, ионных проводников, ферритов, лазерных материалов и т. п. и получать материалы с нужными свойствами (см. легирование). Свойства
Т. р. могут изменяться в результате термич. обработки, которая позволяет получать Т. р. либо в неравновесном состоянии (закалка), либо в состоянии, в той или иной степени приближенном к равновесному (отжиг, отпуск). Термин "Т. р." предложен Я. Вант-Гоффом в 1890.
Лит.: Макаров Е. С., Изоморфизм атомов в кристаллах, М., 1973; Хачатурян А. Г., Теория фазовых превращений и структура твердых растворов, М., 1974; Урусов В. С., Теория изоморфной смесимости, М., 1977; его же, Теоретическая кристаллохимия, М., 1987; Федоров П. П., Соболев Б. П., Федоров П. И., "Кристаллография", 1981, т. 26, № 3, с. 512–20; Китайгородский А. И., Смешанные кристаллы, М., 1983.
П. И. Федоров
Значения в других словарях
- ТВЕРДЫЕ РАСТВОРЫ — ТВЕРДЫЕ РАСТВОРЫ — однородные твердые вещества, состоящие из нескольких компонентов, концентрации которых могут быть изменены в некоторых пределах при данных температуре, давлении и т. п. без нарушения однородности. Многие металлические сплавы (напр. Большой энциклопедический словарь
- Твердые растворы — I см. Сплавы. II (дополнение к статье) см. также Сталь. Энциклопедический словарь Брокгауза и Ефрона
