сера
СЕРА (Sulfur) S
хим. элемент VI гр. периодической системы, ат. н. 16, ат. м. 32,066; относится к халькогенам. Природная С. состоит из четырех изотопов: 32S (95,084%), 33S(0,74%), 34S(4,16%), 36S(0,016%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 0,52∙10−28 м2. Конфигурация внеш. электронной оболочки атома 3s2 3р4; наиб. характерные степени окисления −2, +4, +6; энергии ионизации при последоват. переходе от S0 к S6+ равны соотв. 10,3601, 23,35, 34,8, 47,29, 72,5, 88,0 эВ; сродство к электрону 2,0772 эВ; электроотрицательность по Полингу 2,58; атомный радиус 0,104 нм. ионные радиусы (в скобках даны координац. числа), нм: S2− 0,170 (6), S4+ 0,051 (6), S6+ 0,026 (4).
С. — довольно распространенный элемент, среднее содержание в земной коре 0,05 % по массе, в воде морей и океанов 0,09%. Известны многочисл. минералы С.: самородная С. (главные месторождения в США, СНГ, Мексике, Италии, Японии); сульфидные минералы-пирит FeS2, антимонит Sb2S3, галенит PbS, киноварь HgS, сфалерит и вюрцит ZnS, ковеллин CuS, халькозин Cu2S, аргентит Ag2S, висмутин Bi2S3, халькопирит CuFeS2 и др.; сульфаты — барит BaSO4, ангидрит CaSO4, гипс CaSO4∙2H2O, мирабилит Na2SO4 ∙ 10H2 О и др. Кроме того, С. присутствует в виде соед. в углях, сланцах, нефти, прир. газах. С. — биогенный элемент, входит в состав белков, витаминов.
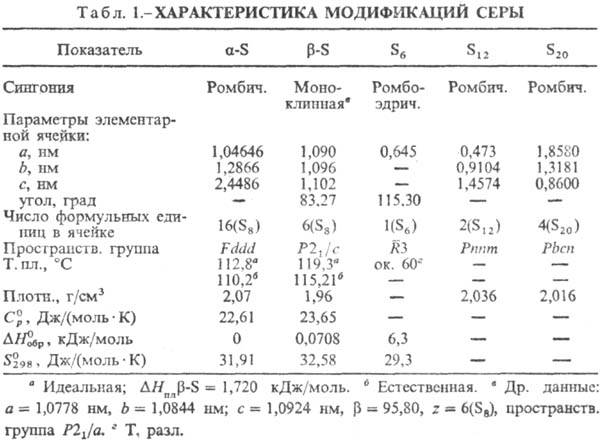
Свойства. До 95,39 °C стабильна α-S — при комнатной температуре лимонно-желтые кристаллы (табл. 1); выше 95,39° С стабильна β-S — при комнатной температуре бледно-желтые кристаллы, ΔН перехода α β 0,400 кДж/моль. Кристаллич. структура α- и β-S построена из неплоских восьмичленных циклич. молекул S8 в виде короны. α- и β-S различаются взаимной ориентацией молекул S8 в кристаллич. решетке.
β 0,400 кДж/моль. Кристаллич. структура α- и β-S построена из неплоских восьмичленных циклич. молекул S8 в виде короны. α- и β-S различаются взаимной ориентацией молекул S8 в кристаллич. решетке.
С. легко образует циклич. молекулы с разным числом атомов п. Для циклич. молекул найдены след. значения энергии связи (Е, кДж/моль) S—S:
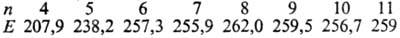
Цикл S8 предпочтителен, др. циклы менее устойчивы, особенно S5 и S4. Получены метастабильные модификации от оранжевого (S6) до лимонно-желтого (S20) цвета.
При быстром охлаждении бензольного раствора С. получена метастабильная, т. наз. перламутровая, С, содержащая в структуре циклы S8, отличающиеся по конфигурции от молекул S8 α- и β-S. Известна ромбоэдрическая С., образованная молекулами S6. Аморфную [плотн. 1,92 г/см3, 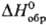 0,397 кДж/моль,
0,397 кДж/моль, 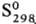 33,18 Дж/(моль∙К)] и пластическую (резиноподобную) С. получают при резком охлаждении расплавленной С.; напр., пластич. форму — выливанием расплава С. с температурой 190 °C в холодную воду. Эти формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm. Аморфная и все др. формы С. превращ. в α-S при длит. выдерживании их при 20–95 °C. При 96–110 °C аморфная и все др. формы С., в т. ч. а, переходят в β-S. При давлении 1,6–2,7 ГПа С. претерпевает новые полиморфные превращения. Уравнения температурной зависимости давления пара: над α-S lgp(Па) = 16,557--5166/Т (20–80 °C), над β-S lgp(Па) = 16,257-5082/Т (96–116 °C). Твердые и жидкая формы С. диамагнитны, магн. восприимчивость α-S — 1,56∙10−7, β-S — 1,4∙10−7. Парамагнитна молекула S2. α-S относят либо к высокоомным полупроводникам, либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, ρ 1,9∙1017 Ом∙см; температурный коэф. линейного расширения 4,567∙10−5 °C−1 (0–13 °C), 2,67∙10−6 °C−1 (78–97 °C), 10,32 °C−1 (98–110 °C); теплопроводность 1,994 Вт/(см∙К).
33,18 Дж/(моль∙К)] и пластическую (резиноподобную) С. получают при резком охлаждении расплавленной С.; напр., пластич. форму — выливанием расплава С. с температурой 190 °C в холодную воду. Эти формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm. Аморфная и все др. формы С. превращ. в α-S при длит. выдерживании их при 20–95 °C. При 96–110 °C аморфная и все др. формы С., в т. ч. а, переходят в β-S. При давлении 1,6–2,7 ГПа С. претерпевает новые полиморфные превращения. Уравнения температурной зависимости давления пара: над α-S lgp(Па) = 16,557--5166/Т (20–80 °C), над β-S lgp(Па) = 16,257-5082/Т (96–116 °C). Твердые и жидкая формы С. диамагнитны, магн. восприимчивость α-S — 1,56∙10−7, β-S — 1,4∙10−7. Парамагнитна молекула S2. α-S относят либо к высокоомным полупроводникам, либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, ρ 1,9∙1017 Ом∙см; температурный коэф. линейного расширения 4,567∙10−5 °C−1 (0–13 °C), 2,67∙10−6 °C−1 (78–97 °C), 10,32 °C−1 (98–110 °C); теплопроводность 1,994 Вт/(см∙К).
Мн. модификации С. характеризуются "идеальной" температурой плавления-для С, расплав которой перед кристаллизацией содержал практически один сорт молекул (в осн. S8), и "естественной" температурой плавления-для С., расплав которой перед кристаллизацией длительно выдерживался и в результате содержал смесь разл. молекул (такие расплавы обозначают Sλ, Sπ, Sm). Например, для перламутровой С. идеальная т. пл. 106,8 °C, естественная т. пл. 103,5 °C. Sλ отделяют от Sπ и Sm обработкой CS2, в котором. Sλ раств., а Sπ (содержит полимерные цепи из S8) и Sm (содержит полимерные цепи из одноатомной S)-нет.
Расплав С. вблизи температуры плавления-подвижная желтая жидкость, содержит циклич. молекулы S8 и, в незначит. степени, Sn, где n = 6, 7, 9, 10; η 0,011 Па∙с (120 °C), γ 60,83 мН/м (120 °C). При нагр. выше 120 °C циклич. молекулы превращ. в полимерные цепи Sm, процесс протекает заметно при ~ 160 °C, этой же температуре отвечает максимум (159,6 °C) на кривой зависимости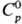 от температуры; η резко увеличивается от 6,5∙10−3 Па∙с (155 °C) до 93,3 Па∙с (187 °C); γ 56,67 мН/м (150 °C). При 187 °C расплав темно-коричневого цвета, практически нетекуч. При нагр. выше 187 °C цепи разрываются, укорачиваются, жидкость вновь становится подвижной, напр. η при 355 °C 0,432 Па∙с, при 444 °C 0,083 Па∙с; уравнения температурной зависимости: плотности d = 1,9035 — — 0,000832/ (120 < t < 155 °C), d = 1,8818 — 0,0006235t (157 < <t<444 °C), давления пара над жидкой С. lgp (мм рт. ст.) = 12647 — 46,433∙105/T — 12,96T + 6,0625∙10−3 Т2 (388 < Т< 742 К); tкрит 1040 °C, pкрит 11,8 МПа, dкрит 0,119 г/см3.
от температуры; η резко увеличивается от 6,5∙10−3 Па∙с (155 °C) до 93,3 Па∙с (187 °C); γ 56,67 мН/м (150 °C). При 187 °C расплав темно-коричневого цвета, практически нетекуч. При нагр. выше 187 °C цепи разрываются, укорачиваются, жидкость вновь становится подвижной, напр. η при 355 °C 0,432 Па∙с, при 444 °C 0,083 Па∙с; уравнения температурной зависимости: плотности d = 1,9035 — — 0,000832/ (120 < t < 155 °C), d = 1,8818 — 0,0006235t (157 < <t<444 °C), давления пара над жидкой С. lgp (мм рт. ст.) = 12647 — 46,433∙105/T — 12,96T + 6,0625∙10−3 Т2 (388 < Т< 742 К); tкрит 1040 °C, pкрит 11,8 МПа, dкрит 0,119 г/см3.
Т. кип. С. 444,6 °C, ΔHисп 9,2 кДж/моль. Пар содержит молекулы Sn, где n = 2–12 (табл. 2). при 150 °C в паре преобладают молекулы S8, в меньшей степени присутствуют S6 и S7, при 444,6 °C-S8, S6, S7, незначительно S2, при 600 °C-S8, S6, S7 в равных количествах, меньше S2, при 700 °C-примерно в равных количествах S2, S6, S8, S7, незначительно S3, выше 730 °C преобладают молекулы S2, выше 1500 °C-одноатомная S.
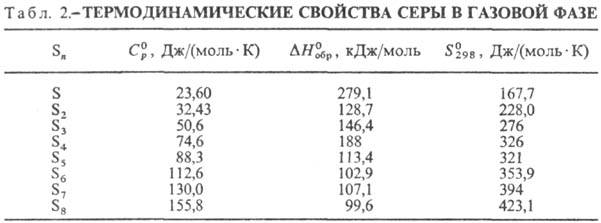
С. не раств. в воде, плохо раств. в этаноле, гептане, гексане, лучше — в толуоле, бензоле (табл. 3). Лучшие растворители для С. — жидкий NH3 (под давлением), CS2, S2C12.
Последние два используют в промышленности как растворители С, S2Cl2 — при вулканизации каучука; 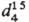 растворов С. в CS2 (в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20). С., содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2. В расплавленной С. заметно раств. H2S, SO2, As2S3, P2S5 и др.
растворов С. в CS2 (в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20). С., содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2. В расплавленной С. заметно раств. H2S, SO2, As2S3, P2S5 и др.
Конц. H2 SO4 окисляет расплавленную С. при ~120 °C до SO2, конц. HNO3, смеси соляной кислоты с окислителями (KClO3, HNO3)-до H2SO4. Разб. HNO3, соляная кислота без добавок окислителей, H2 SO4 на холоду с С. не реагируют. Мелкодисперсная С. взаимод. при нагр. с растворами щелочей, давая сульфиты и сульфиды, а затем полисульфиды и тио-сульфаты. С. непосредственно соединяется почти со всеми элементами, кроме инертных газов, иода, азота, Pt, Au. При 280 °C сера горит в O2, а при 360 °C в воздухе, образуя в осн. серы диоксид, а также серы триоксид. Смесь паров С. и O2 взрывается.
Оксиды С., кроме SO2 и SO3, неустойчивы. S2O-газ; 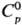 44,3 Дж/(моль∙К);
44,3 Дж/(моль∙К); 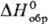 −108,9 кДж/моль;
−108,9 кДж/моль; 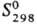 267,3 Дж/(моль∙К); образуется при пропускании SO2 в тлеющем разряде. Кристаллич. S8O образуется при взаимодействии H28„ с SOCl2, жидкий SO4 (т. пл. 3 °C, с разл.) — из SO2 и O2 в тлеющем разряде при −190 °C. Жидкий S2O7 (т. пл. 0 °C,
267,3 Дж/(моль∙К); образуется при пропускании SO2 в тлеющем разряде. Кристаллич. S8O образуется при взаимодействии H28„ с SOCl2, жидкий SO4 (т. пл. 3 °C, с разл.) — из SO2 и O2 в тлеющем разряде при −190 °C. Жидкий S2O7 (т. пл. 0 °C, 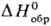 −811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении SO4. Соед. SO4 и S2 O7 содержат пероксидную группировку —O—O—, формально им соответствуют пероксомоносерная кислота (кислота Каро) H2SO5 (т. пл. 47 °C, с разл.) и пероксодисерная кислота H2S2O8 (т. пл. 65 °C, с разл.), которые образуются при электролизе H2SO4 или гидросульфатов при производстве H2O2. Известны также S6O и S7O2.
−811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении SO4. Соед. SO4 и S2 O7 содержат пероксидную группировку —O—O—, формально им соответствуют пероксомоносерная кислота (кислота Каро) H2SO5 (т. пл. 47 °C, с разл.) и пероксодисерная кислота H2S2O8 (т. пл. 65 °C, с разл.), которые образуются при электролизе H2SO4 или гидросульфатов при производстве H2O2. Известны также S6O и S7O2.
С галогенами, кроме I2, С. образует серы галогениды, с водородом — сероводород, сульфаны, с углеродом — сероуглерод, с металлами и более электроположит., чем С., неметаллами-сульфиды (см. сульфиды неорганические), с Se-фазу с широкой областью гомогенности (50–60% ат. % Se), с Те при сверхвысоких давлениях-Te7S10. Известны нитриды С.: циклич. S4 N4, который при нагр. над Ag превращается в др. соед., молекулы которого представляют собой плоские циклы S2N2; (SN)x (образуется при полимеризации S2N2)-золотистое вещество с металлич. проводимостью, вблизи 0 К-сверхпроводник; S4N2 и др. Известны соед., содержащие С. в катионной форме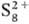 ,
, 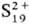 и др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3]. О кислотах С., их солях см. политионаты, серная кислота, сульфаты неорганические, сульфиты неорганические, тиосульфаты неорганические и др.,-об орг. соединениях С.-Сераорганические соединения и др.
и др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3]. О кислотах С., их солях см. политионаты, серная кислота, сульфаты неорганические, сульфиты неорганические, тиосульфаты неорганические и др.,-об орг. соединениях С.-Сераорганические соединения и др.
Получение. С. добывают из самородных руд, а также получают окислением H2S или восстановлением SO2. Существует неск. методов добычи. С. из руд: 1) геотехнологический метод переработки самородной С. заключается в выплавке С., находящейся в недрах Земли, без подъема руды на поверхность. В серосодержащий пласт подают под давлением по трубам водяной пар, сжатым воздухом расплавленную С. поднимают на поверхность. 2) По термическому методу С. либо выплавляют из дробленой руды в камерных печах, либо возгоняют во вращающихся печах. 3) Экстракционный метод (применяется ограниченно) состоит в извлечении С. из руд сероуглеродом. 4) Пароводяной метод (для руд с высоким содержанием С.) заключается в обработке дробленой руды в автоклавах острым Паром. 5) Флотационные методы предусматривают обогащение руд и затем извлечение С. пароводяным методом; вводятся реагенты для увеличения гидрофиль-ности частиц руды и гидрофобности С. 6) При получении С. методом флокуляции концентрат поступает а плавильник, оттуда во флокулятор, где к образовавшейся суспензии добавляют коагулянт (высококипящая жидкость, содержащая воду), затем флокулы пустой породы отделяют от жидкой С.
С. получают из H2S пром. газов (генераторный, коксовый, газы нефтепереработки) и прир. газов: 1) извлекают H2S из газа щелочными растворами, затем перерабатывают десорбиро-ванный H2S методом контактного окисления-часть H2S окисляется до SO2 (сгорание), после чего смесь H2S и SO2 реагирует на слое боксита при 270–300 °C, давая С. и H2O. 2) В процессе сухой очистки газа H2S на фильтре с активир. углем окисляется при 40 °C до С. и H2O.
Из SO2 С. получают в сочетании с выплавкой Fe и Cu из сульфидных руд. В печи в шихте (руда, кокс, кварц, известняк) вначале отщепляется один атом S от FeS2, затем FeS окисляется с образованием SO2, который восстанавливается коксом до С. Газ, выходящий при ~ 450 °C, содержит пары S, SO2, COS, CS2, H2 S; его очищают от пыли и направляют в первый контактный аппарат, где на боксите при 450 °C COS и CS2 реагируют с SO2 с выделением С. При переработке SO2 из отходящих газов цинкового (из ZnS) и др. производств также получают С.
Сорта С.: выплавленную из самородных руд С. наз. природной комовой, полученную из H2S и SO2-гa-зовой комовой, природную комовую, очищенную пере-гонкой,-рафинированной, сконденсированную из паров выше температуры плавления и разлитую из жидкого состояния в формы-черенковой, сконденсированную в твердое состояние-серным цветом. Высокодисперсную С. наз. коллоидной.
Для рафинирования С. используют хим. методы-путем перевода примесей в др. степени окисления с послед. их отделением. Для уменьшения содержания As и Se С. обрабатывают смесью конц. HNO3 и H2SO4, отмывают от кислот, кипятят с обратным холодильником и сублимируют в вакууме. Для очистки от углерода (битумов) используют хим.-термич. метод-нагревают С. в кварцевом реакторе при ~ 800 °C, при этом углеродсодержащие вещества обугливаются и легко отделяются.
Глубокую очистку С. в осн. осуществляют дистилляцией и ректификацией. Для дальнейшей очистки С. от примесей (Н, С, О, Se, As и др.) перспективны кристаллизац. методы, среди них-способ противоточной кристаллизации из расплава. Получена высокочистая С. с содержанием примесей 10−5–10−6 % по массе.
Определение. Качественно и количественно С. определяют путем перевода в растворимые сульфаты, а затем в BaSO4. Прир. объекты обрабатывают соляной кислотой, затем отгоняют H2 S. Свободную С. извлекают бензолом, пиритную-разб. HNO3, в составе орг. соед. — смесью HNO3 с KMnO4. Для определения С. в сталях и ферросплавах пробу раств. в смеси соляной и азотной кислот, затем Fe(III) переводят в Fe(II), удаляют NО−3 , определяют С. в виде BaSO4. В воздухе С. определяют колориметрически-сжигают С. в токе O2, окисляют образовавшийся SO2 до H2 SO4 и определяют ее в виде BaSO4 в водно-спиртовом растворе. Для определения малых количеств (10−4 %) С. применяют фотоколориметрич. метод-после обработки пробы с получением H2S, поглощение H2S раствором щелочи, С. определяют по изменению окраски метиленового синего.
Применение. Ок. 50% производимой С. используют для производства H2SO4, ок. 25%-для получения сульфитов, 10–15%-для борьбы с вредителями с.-х. культур (гл. обр. винограда и хлопчатника), ок. 10% — в резиновой промышленности (как вулканизующий агент). С. применяют в производстве красителей, ВВ, искусств. волокна, люминофоров, CS2, сульфидов, в орг. синтезе и др., она входит в состав головок спичек, мазей для лечения кожных заболеваний. Небольшие добавки С. улучшают обрабатываемость автоматных сталей и анти-фрикц. свойства спеченных антифрикц. материалов.
Мировое производство С. 53 млн. т (1984).
Соединения С. по отрицат. воздействию на окружающую среду занимают одно из первых мест среди загрязняющих веществ. Осн. источник загрязнения соединениями С. — сжигание угля и нефтепродуктов. 96% С. поступает в атмосферу в виде SO2, остальное количество приходится на сульфаты, H2S, CS2, COS и др. В виде пыли элементная С. раздражает органы дыхания, слизистые оболочки, может вызывать экземы и др. ПДК в воздухе 0,07 мг/м3 (аэрозоль, класс опасности 4). Мн. соед. S токсичны.
С. известна с глубокой древности, ее начали использовать ок. 2000 до н. э.; напр., в Египте ее применяли для дезинфек-ции, беления тканей и др.
Лит.: Авдеева А. А., в сб.: Основы металлургии, т. 5, М., 1968, с. 483–504; Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Ьу-севА. И., Симонова Л.Н., Аналитическая химия серы, М., 1975; Глобальный биогеохимический цикл серы и влияние на него деятельности человека, М., 1983; Чурбанов М.Ф., Скрипачев И. В., "Высокочистые вещества", 1988, № 3, с. 92–107.
И. Н. Один
Значения в других словарях
- Сера — (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06. Природная С. состоит из четырёх стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Большая советская энциклопедия
- сера — -ы, ж. 1. Химический элемент, легко воспламеняющееся вещество желтого цвета (применяется в промышленности, военном деле, сельском хозяйстве, медицине). 2. Желтое жирное вещество, образующееся на стенках ушного канала. 3. обл. Малый академический словарь
- сера — Се́р/а. Морфемно-орфографический словарь
- сера — орф. сера, -ы Орфографический словарь Лопатина
- сера — Латинское – sera (воск). Старославянское – с(ять)ра. Древнерусское – с(ять)ра. Слово «сера», известное в древнерусском языке с XV в., заимствовано из старославянского, где «с(ять)ра» – «сера, смола», вообще «горючее вещество, жир». Этимологический словарь Семёнова
- Сера — Сера (евр. гофрит; греч. тейон). В долине Иордана, а также в меловых и известковых осадочных породах на берегах Мертвого моря издавна были известны горячие серные источники (прежде всего близ Тивериады и на Ярмуке) и отложения С. В Библии... Библейская энциклопедия Брокгауза
- Сера — (Быт 19:24) — известное минеральное вещество, легко воспламеняющееся и при горении издающее удушливый запах. Мы знаем, что города долины Содома и Гоморры были разрушены дождем, состоявшим из серы и огня. Библейская энциклопедия архим. Никифора
- Сера — Двуокись серы Универсальное дезинфицирующее средство, чаще всего применяемое виноделами для предотвращения уксусного брожения, а при производстве белых вин — дополнительно для защиты от вредных бактерий. В виноделии почти везде используется двуокись серы. Вино. Энциклопедический словарь
- сера — СЕРА (Sulfur) , S, хим. элемент VI гр. периодич. системы элементов Менделеева. Встречается элементарная С. и в виде сульфатов и сульфидов. Содержится в углях, нефти, почвах (до 90% в ор-ганич. форме, 10 — 15% в виде сульфатов). Сельскохозяйственный словарь
- сера — С’ера (Быт.19:24 ; Втор.29:23 ; Рим.18:15 ; Пс.10:6 ; Ис.30:33 ; Ис.34:9 ; Иез.38:22 ; Лук.17:29 ; Отк.9:17 ,18; Отк.14:10 ; Отк.19:20 ; Отк.20:10 ; Отк.21:8) — желтое или сероватое вещество, часто встречающееся в природе в свободном виде. Библейский словарь Вихлянцева
- сера — Общеслав. Происхождение не ясно. Слово то связывают с серый, то объясняют как заимств. из лат. яз. (лат. sēra «воск», serum «сыворотка»). Этимологический словарь Шанского
- СЕРА — СЕРА (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов... Научно-технический словарь
- сера — Сера, Двуокись серы Универсальное дезинфицирующее средство, чаще всего применяемое виноделами для предотвращения уксусного брожения, а при производстве белых вин — дополнительно для защиты от вредных бактерий. *** Кулинарный словарь
- Сера — (Sulfur; S) химический элемент VI группы периодической системы Д. И. Менделеева; атомный номер 16, атомная масса 32,06; твердое кристаллическое вещество желтого цвета, нерастворимое в воде; используется при изготовлении некоторых лекарственных средств... Медицинская энциклопедия
- сера — СЕРА, ы, ж. 1. Химический элемент жёлтое горючее вещество, применяемое в технике и медицине. 2. Жёлтое жирное вещество, образующееся в ушном канале. | прил. серный, ая, ое. Толковый словарь Ожегова
- сера — С’ЕРА, серы, мн. нет, ·жен. 1. Металлоид, легко воспламеняющееся вещество желтоватого или сероватого цвета, применяемое в медицине и технике. 2. Жирное густое вещество желтого цвета, образующееся на стенках ушного канала (·разг. ). Скопление серы. Толковый словарь Ушакова
- сера — СЕРА -ы; ж. 1. Химический элемент (S); легко воспламеняющееся вещество жёлтого цвета (применяется в промышленности, военном деле, сельском хозяйстве, медицине). 2. Жёлтое жирное вещество, образующееся на стенках ушного канала. Прочистить от серы уши. ◁ Серный (см.). Толковый словарь Кузнецова
- сера — СЕРА ж. одно из простых (несложных, неразлагаемых) веществ, плавкое и сильно горючее ископаемое вулканического рожденья; как товар, зовут ее: сера горючая. Порох делается из селитры и серы, с углем. Черенковая сера, отлитая палочками. Толковый словарь Даля
- СЕРА — СЕРА (Seurat) Жорж (1859-91) — французский живописец. Основоположник неоимпрессионизма. Жанрово-пейзажные композиции, исполненные мелкими мозаичными мазками, сочетают обобщенность форм с тонкостью наблюдений ("Цирк", 1890-91). СЕРА (лат. Большой энциклопедический словарь
- сера — се́ра укр. сíра, др.-русск. сѣра, сербск.-цслав. сѣра θεῖον, болг. ся́ра, чеш. síra, слвц. sirkа "спичка", польск. siara, siarka. Лит. sierà "сера", лтш. sę̃rs – то же заимств. из вост.-слав. (М.–Э. 3, 830). Праслав. Этимологический словарь Макса Фасмера
- сера — сера ж. 1. Химический элемент, легко воспламеняющееся вещество желтого или сероватого цвета. 2. разг. Жирное густое вещество желтого цвета, образующееся на стенках ушного канала. 3. местн. Смола, выделяющаяся из хвойных деревьев. Толковый словарь Ефремовой
