осмос
ОСМОС (от греч.  — толчок, давление)
— толчок, давление)
самопроизвольный перенос вещества через полупроницаемую мембрану, разделяющую два раствора разл. концентрации или чистый растворитель и раствор. Наиб. часто происходит переход растворителя через полупроницаемую мембрану, не пропускающую растворенное вещество. Самопроизвольный массоперенос возникает в результате того, что хим. потенциал растворителя уменьшается при увеличении концентрации растворенного вещества.
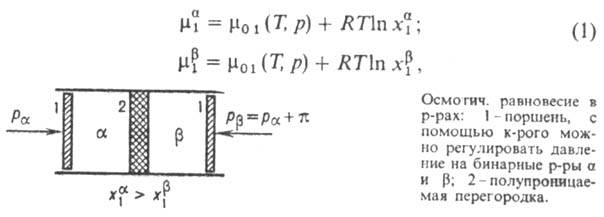
Рассмотрим два объема α и  бинарного раствора (см. рис.), разделенных полупроницаемой перегородкой, пропускающей молекулы растворителя (компонент 1) и не пропускающей молекулы растворенного вещества (компонент 2). Если температура T и давление р по обе стороны перегородки одинаковы (Тα= Т
бинарного раствора (см. рис.), разделенных полупроницаемой перегородкой, пропускающей молекулы растворителя (компонент 1) и не пропускающей молекулы растворенного вещества (компонент 2). Если температура T и давление р по обе стороны перегородки одинаковы (Тα= Т ,
, 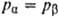 ), а молярные доли различны (
), а молярные доли различны (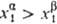 ), то
), то 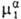 (Т, р,
(Т, р, 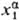 ) >
) > 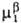 (Т, р,
(Т, р,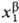 ). Для идеальных или сильно разбавленных реальных растворов, где
). Для идеальных или сильно разбавленных реальных растворов, где 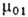 -хим. потенциал чистого растворителя, R-газовая постоянная. При
-хим. потенциал чистого растворителя, R-газовая постоянная. При 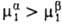 система термодинамически неравновесна и, следовательно, имеет место переход компонента 1 из объема α в объем
система термодинамически неравновесна и, следовательно, имеет место переход компонента 1 из объема α в объем 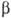 до тех пор, пока его молярные доли в обоих объемах не станут одинаковыми. Для того чтобы предотвратить массоперенос и выравнивание концентраций и сохранить первонач. состав обоих растворов, необходимо выравнить хим. потенциалы компонента 1 по обе стороны перегородки изменением внеш. условий (температуры, давления, внеш. электрич. поля, если речь идет о растворах электролитов). В изотермич. условиях для сохранения состава фаз необходимо изменить давление на один из растворов. Из термодинамики известно, что
до тех пор, пока его молярные доли в обоих объемах не станут одинаковыми. Для того чтобы предотвратить массоперенос и выравнивание концентраций и сохранить первонач. состав обоих растворов, необходимо выравнить хим. потенциалы компонента 1 по обе стороны перегородки изменением внеш. условий (температуры, давления, внеш. электрич. поля, если речь идет о растворах электролитов). В изотермич. условиях для сохранения состава фаз необходимо изменить давление на один из растворов. Из термодинамики известно, что

где 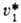 -парциальный молярный объем растворителя. Для идеальных или предельно разбавленных реальных растворов
-парциальный молярный объем растворителя. Для идеальных или предельно разбавленных реальных растворов 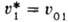 , где
, где 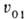 -молярный объем чистого растворителя. Знак производной положительный и при увеличении давления, приложенного к раствору
-молярный объем чистого растворителя. Знак производной положительный и при увеличении давления, приложенного к раствору 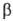 , хим. потенциал растворителя будет возрастать. Дополнит. давление
, хим. потенциал растворителя будет возрастать. Дополнит. давление 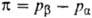 , которое надо приложить к раствору
, которое надо приложить к раствору 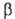 для того, чтобы предотвратить поступление в него растворителя через полупроницаемую мембрану из раствора α, наз. осмотич. давлением. При давлении
для того, чтобы предотвратить поступление в него растворителя через полупроницаемую мембрану из раствора α, наз. осмотич. давлением. При давлении 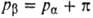 система находится в термодинамически равновесном состоянии:
система находится в термодинамически равновесном состоянии:
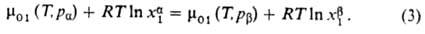
Если 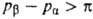 , равновесие нарушается и имеет место перенос растворителя из более концентрир. раствора в менее концентрированный. Это явление получило назв. обратного осмоса; оно находит широкое практич. применение в мембранных процессах разделения веществ.
, равновесие нарушается и имеет место перенос растворителя из более концентрир. раствора в менее концентрированный. Это явление получило назв. обратного осмоса; оно находит широкое практич. применение в мембранных процессах разделения веществ.
Для идеальных растворов зависимость осмотич. давления от состава выражается уравнением:
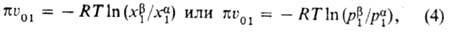
где 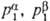 — парциальные давления растворителя в фазах α и
— парциальные давления растворителя в фазах α и 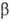 . Если фаза α представляет собой чистый растворитель, т. е.
. Если фаза α представляет собой чистый растворитель, т. е. 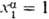 , то
, то 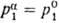 ; уравнение принимает вид, известный как уравнение Ван Лаара:
; уравнение принимает вид, известный как уравнение Ван Лаара:
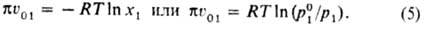
Из него следует, что осмотич. давление раствора пропорционально ln x1. Этой же величине пропорциональны понижение температуры замерзания и повышение температуры кипения идеальных растворов (см. Рауля закон), что свидетельствует о связи этих явлений с О.
Если концентрация растворенного вещества мала, зависимость осмотич. давления от его молярной концентрации с2 выражается уравнением Вант-Гоффа:

Это уравнение обычно используют для расчета осмотич. давления бинарных растворов недиссоциирующих веществ. Однако лучшее совпадение расчетных значений с экспериментальными в широкой концентрац. области дает уравнение Ван Лаара (см. табл.). О методах и технике измерения осмотич. давления см. осмометрия.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ ВОДНЫХ РАСТВОРОВ САХАРОЗЫ ПРИ 30 °C
таблица в процессе добавления
Для разб. растворов электролитов уравнение Вант-Гоффа имеет вид:

где i= 1 + a'(v — 1) (a'-степень диссоциации электролита, v-число ионов, на которые распадается молекула электролита). В случае сильных электролитов, полностью диссоциирующих на ионы, при высоких разбавлениях 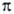 = vc2RT, для раствора произвольной концентрации
= vc2RT, для раствора произвольной концентрации 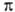 = vФc2RT, где Ф-практич. осмотич. коэффициент. Он непосредственно связан с коэф. активности
= vФc2RT, где Ф-практич. осмотич. коэффициент. Он непосредственно связан с коэф. активности 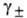 растворенного вещества и моляль-ностью m раствора электролита соотношением Бьеррума:
растворенного вещества и моляль-ностью m раствора электролита соотношением Бьеррума:
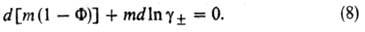
В интегральной форме соотношение (8) принимает вид:
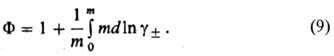
Это соотношение используют для расчета Ф по данным о 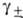 ; можно рассчитать Ф и по значениям
; можно рассчитать Ф и по значениям  .
.
Наиб. существ. черта всех осмотич. процессов — увеличение объема раствора. Оно всегда имеет место, если молекулы растворенного вещества не могут выйти из раствора, а растворитель способен проникать в раствор. Это условие можно выполнить даже при отсутствии видимой полупроницаемой перегородки. Например, если фазы α и  содержат нелетучий компонент и не разделены перегородкой, а находятся под одним колпаком, из-под которого откачан воздух, то за счет разности давлений насыщ. пара произойдет "перекачка" растворителя из раствора α в раствор
содержат нелетучий компонент и не разделены перегородкой, а находятся под одним колпаком, из-под которого откачан воздух, то за счет разности давлений насыщ. пара произойдет "перекачка" растворителя из раствора α в раствор 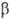 . Такой процесс получил назв. изотермич. перегонки. Др. примером типичного проявления О. без наличия полупроницаемой перегородки является набухание в системах полимер-растворитель.
. Такой процесс получил назв. изотермич. перегонки. Др. примером типичного проявления О. без наличия полупроницаемой перегородки является набухание в системах полимер-растворитель.
Осмос в природе. Животные и растит. клетки представляют собой микроскопич. осмотич. системы, поскольку у клетки оболочка или прилегающая к ней плазмолемма обладают свойствами полупроницаемых мембран. Если поместить клетки в дистиллированную воду, происходит набухание, а затем разрыв оболочек (осмотич. шок, или лизис). В растворах с высокой концентрацией солей наблюдается падение осмотич. давления и коллапс клеток из-за потери воды (плазмолиз). Это явление используют, напр., при консервировании пищ. продуктов путем добавления больших количеств соли или сахара: микроорганизмы подвергаются плазмолизу и становятся нежизнедеятельными.
Растворы с одинаковым значением осмотич. давления наз. изотоническими. Растворы с осмотич. давлением, большим, чем у внутриклеточной жидкости, наз. гипертоническими, меньшим-гипотоническими. Один и тот же раствор для одного типа клеток м. б. гипертоническим, для другого-изотоническим, для третьего-гипотоническим.
В тканях растений осмотич. давление составляет 0,5–2 МПа (у растений в пустынях — более 10 МПа). Гидро-статич. давление, возникшее во внутриклеточных структурах в результате осмоса, наз. тургором. Это давление придает прочность и упругость тканям живых организмов. Если клетка отмирает, оболочка теряет свойство полупроницаемости, тургор исчезает (растение вянет). Осмотич. давление-главная причина, обеспечивающая движение воды в растениях и ее подъем от корней до вершины. Клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последний-из клеток корня, берущих, в свою очередь, воду из почвы. Для роста и развития растений важно соотношение между осмотич. давлением почвенного раствора и клеточного сока. Растение может нормально развиваться лишь тогда, когда осмотич. давление клеточного сока больше осмотич. давления почвенного раствора.
Высокоорганизованные животные и человек отличаются постоянным значением осмотич. давления, напр. в крови человека 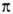 = 0,78 МПа (7,7 атм) при 37 °C. Даже небольшие изменения осмотич. давления вызывают чувство дискомфорта. Так, чувство жажды обусловлено потребностью организма восстановить нормальное осмотич. давление введением воды, после того как оно было повышено, напр. употреблением соленой пищи. При болезненных явлениях локальные изменения осмотич. давления м. б. значительными. Например, при воспалит. процессах происходит распад белков, что приводит к увеличению количества структурных частиц в очаге воспаления, повышению осмотич. давления и локальному оттоку воды из окружающих тканей. Так возникают отеки.
= 0,78 МПа (7,7 атм) при 37 °C. Даже небольшие изменения осмотич. давления вызывают чувство дискомфорта. Так, чувство жажды обусловлено потребностью организма восстановить нормальное осмотич. давление введением воды, после того как оно было повышено, напр. употреблением соленой пищи. При болезненных явлениях локальные изменения осмотич. давления м. б. значительными. Например, при воспалит. процессах происходит распад белков, что приводит к увеличению количества структурных частиц в очаге воспаления, повышению осмотич. давления и локальному оттоку воды из окружающих тканей. Так возникают отеки.
В медицине обычно используют изотонич. растворы, но иногда применяют и гипертонические. Так, в хирургии гипертонич. повязками покрывают раны: гипертонич. повязка оттягивает на себя жидкость и очищает рану от микроорганизмов, продуктов распада и т. д.
Лит.: Горшков В. И., Кузнецов И. А., Физическая химия, М., 1986; Дуров В. А., Агеев Е.П., Термодинамическая теория растворов неэлектролитов, М., 1987. См. также лит. при ст. мембранные процессы разделения.
Е. П. Агеев
Значения в других словарях
- осмос — Явление переноса растворителя через непроницаемую для растворенных веществ мембрану, разделяющую два раствора разной концентрации. Играет большую роль в жизнедеятельности живых организмов, используется при исследовании полимеров, биол. структур. Микробиология. Словарь терминов
- осмос — -а, м. физ. Проникновение, просачивание растворителя в раствор сквозь разделяющую их полупроницаемую перегородку. [От греч. ’ωσμός — толчок, давление] Малый академический словарь
- осмос — О́смос/. Морфемно-орфографический словарь
- Осмос — (от греч. ōsmós — толчок, давление) диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. Большая советская энциклопедия
- осмос — орф. осмос, -а Орфографический словарь Лопатина
- осмос — ОСМОС — диффузия молекул воды через полупроницаемую мембрану по направлению от раствора малой концентрации к более концентрированному, обладающему меньшим водным потенциалом. Ботаника. Словарь терминов
- ОСМОС — ОСМОС, односторонняя диффузия РАСТВОРИТЕЛЯ (такого как вода) через естественную или искусственную полупроницаемую мембрану (перегородка, пропускающая только определенные растворенные вещества) в более концентрированный раствор. Научно-технический словарь
- Осмос — (греч. ōsmos толчок, проталкивание, давление) самопроизвольный переход вещества, обычно растворителя, через полупроницаемую мембрану, отделяющую раствор от чистого растворителя или от раствора меньшей концентрации. Медицинская энциклопедия
- осмос — ОСМОС -а; м. [от греч. ōsmos — толчок, давление] Физ. Проникновение, просачивание растворителя в раствор сквозь разделяющую их полупроницаемую перегородку. ● Впервые осмос наблюдал А.Нолле в середине 18 в. ◁ Осмотический, -ая, -ое. Толковый словарь Кузнецова
- осмос — Осмоса, м. [греч. osmos – толчок, давление] (физ.). Просачивание жидких веществ сквозь полупроницаемые животные или растительные перепонки, ткани. Явление осмоса играет большую роль в обмене питательными веществами в организме. Большой словарь иностранных слов
- осмос — ’ОСМОС, осмоса, ·муж. (·греч. osmos — толчок, давление) (физ.). Просачивание жидких веществ сквозь полупроницаемые животные или растительные перепонки, ткани. Явление осмоса играет большую роль в обмене питательными веществами в организме. Толковый словарь Ушакова
- Осмос — Своеобразная форма явлений диффузии (см.), приобревшая весьма важное значение в теории растворов. Явления О. наблюдаются, когда жидкости приходят во взаимодействие через перепонки. Если взять сосуд, в котором вместо дна — перепонка, напр. Энциклопедический словарь Брокгауза и Ефрона
- ОСМОС — ОСМОС (от греч. osmos — толчок, давление) — односторонний перенос растворителя через полупроницаемую перегородку (мембрану) — отделяющую раствор от чистого растворителя или раствора меньшей концентрации. Большой энциклопедический словарь
- осмос — осмос м. Явление медленного просачивания растворов сквозь проницаемые органические перегородки. Толковый словарь Ефремовой
