окислительно-восстановительные реакции
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (реакции окисления-восстановления)
происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении — понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением — отнятие кислорода. С введением в химию электронных представлений понятие О.-в. р. было распространено на реакции, в которых кислород не участвует.
В неорг. химии О.-в.р. формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), напр.:
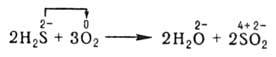
При этом окислитель восстанавливается, а восстановитель окисляется. При протекании реакций в гальванич. элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса DG в данной реакции м. б. превращено в полезную работу. В отличие от реакций ионного обмена О.-в. р. в водных растворах протекают, как правило, не мгновенно.
При О.-в.р. атомы в высшей степени окисления являются только окислителями, в низшей — только восстановителями; атомы в промежут. степени окисления в зависимости от типа реакции и условий ее протекания м. б. окислителями или восстановителями. Многие О.-в. р. — каталитические (см. окислительно-восстановительный катализ).
По формальным признакам О.-в.р. разделяют на межмол. (напр., 2SO2 + O2 → SO3) и внутримол., напр.:
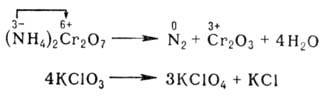
Последняя реакция представляет собой самоокисление-самовосстановление (см. диспропорционирование).
О.-в.р. часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрич. энергии. Наиб. энергичные О.-в.р. протекают при взаимодействии восстановителей с окислителями в отсутствие растворителя; в растворах такие реакции м. б. невозможны вследствие окислительно-восстановит. взаимод. одного или обоих реагентов с растворителем. Так, в водном растворе нельзя непосредственно провести реакцию 2Na + F2 → 2NaF, поскольку натрий и фтор бурно взаимод. с водой. На окислительно-восстановит. свойства ионов сильно влияет комплексообразование, напр.: комплекс [Co2+(CN)6]4−, в отличие от гидратир. иона Со2+, является сильным восстановителем.
В случае О.-в.р. в орг. химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при нез-начит. полярности связей между атомами, участвующими в реакции. В орг. химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от орг. соед. к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т. п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т. п.), напр.: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении орг. соед. в результате приобретения электронов происходят обратные процессы, напр.: R2CO → R2CH2; RSO2C1 → RSO2H.
Используют также подход, при котором атомам С в молекуле приписывают разл. степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функцией, производные можно расположить в порядке возрастания их степени окисления. Так, насыщ. углеводороды относят к нулевой группе (приблизит, степень окисления −4), R2C = = CR2, ROH, RCl и RNH2- к первой (- 2), RC≡CR, R2CO и R2CCl2 — ко второй (0), RCOOH, RC≡CC1, RCONH2 и RCCl3 — к третьей (+2), RCN, CCl4 и CO2 — к четвертой (+ 4). Тогда окисление-процесс, при котором соед. переходит в более высокую категорию, восстановление — обратный процесс.
Механизмы О.-в.р. весьма разнообразны; реакции могут протекать как по гетеролитическому, так и по гомолитич. механизму. Во мн. случаях начальная стадия реакции — процесс одноэлектронного переноса. Окисление обычно протекает по положениям с наиб. электронной плотностью, восстановление — по положениям, где электронная плотность минимальна.
В орг. химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т. е. способностью действовать избирательно на определенные функц. группы), а также получать продукты в требуемой степени окисления. Например, борогидрид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соед. до спиртов. Среди окислителей высокой селективностью обладают, напр., комплекс CrO3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С — С, а также SeO2, окисляющий кетоны и альдегиды до a-дикарбонильных соединений.
Селективность О.-в.р. может быть обеспечена и в каталитич. процессах; напр., в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщ. углеводородов (см. гидрирование). Электрохим. восстановление CO2 до CO в водной среде в присутствии никелевого комплекса 1, 4, 8, 11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких потенциалах и одновременно подавлять электролиз воды с образованием H2. Эта реакция имеет ключевое значение для превращения CO2 через CO в разнообразные орг. вещества.
Каталитич. О.-в.р. играют важную роль в промышленности, напр.:
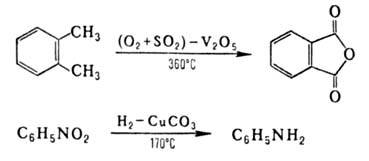
О.-в.р. широко распространены в природе и используются в технике. В основе жизни лежат О.-в.р., происходящие при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают осн. часть энергопотребления человечества за счет сжигания орг. топлива. Получение металлов, извлечение энергии взрыва основано на О.-в.р.
Лит.: Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980; Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119–41, 308–43; Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259–341; ТурьяиЯ.И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989; Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989.
С. И. Дракин, З. В. Тодрес
Значения в других словарях
- Окислительно-восстановительные реакции — В организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). О.-в. Большая советская энциклопедия
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, напр.:HCl+5O3+3H2S+4O3 ??HCl-1+3H2S+6O4 Вещество, в котором понижается степень окисления атома, т. Большой энциклопедический словарь
