молекулярная масса
МОЛЕКУЛЯРНАЯ МАССА
сумма масс атомов, входящих в состав данной молекулы; выражается в атомных единицах массы (а.е. м.). Поскольку 1 а.е.м. (иногда называемая дальтон, D) равна 1/12 массы атома нуклида 12С и в единицах массы СИ составляет 1,66057∙10−27 кг, то умножение М.м. на 1,66057∙10−27 дает абс. массу молекулы в килограммах. Чаще пользуются безразмерной величиной Мотн-относительной М.м.: Мотн =Mx/D, где Мх-масса молекулы x, выраженная в тех же единицах массы (кг, г или др.), что и D. М. м. характеризует среднюю массу молекулы с учетом изотопного состава всех элементов, образующих данное хим. соединение. Иногда М. м. определяют для смеси разл. веществ известного состава, напр. для воздуха "эффективную" М.м. можно принять равной 29.
Абс. массами молекул удобно оперировать в области физики субатомных процессов и радиохимии, где путем измерения энергии частиц, согласно теории относительности, определяют их абс. массы. В химии и хим. технологии необходимо применять макроскопич. единицы измерения количества вещества. Число любых частиц (молекул, атомов, электронов или мысленно выделяемых в веществе групп частиц, напр. пар ионов Na+ и Cl− в кристаллич. решетке NaCl), равное Авогадро постоянной NА = 6,022∙1023, составляет макроскопич. единицу количества вещества-моль. Тогда можно записать: Мотн = Mx∙NA/(D∙NA),T.е. относительная М.м. равна отношению массы моля вещества к NAD. Если вещество состоит из молекул с ковалентными связями между составляющими их атомами, то величина Mx∙NA представляет собой м о л я рн у ю м а с с у этого вещества, единицы измерения которой кг-моль (киломоль, кМ). Для веществ, не содержащих молекул, а состоящих из атомов, ионов или радикалов, определяется ф о р-м у л ь н а я м о л я р н а я м а с с а, т. е. масса NA частиц, соответствующих принятой формуле вещества (однако в СССР часто и в этом случае говорят о М.м., что неверно).
Ранее в химии использовали понятия грамм-молекула, грамм-атом, грамм-ион, теперь-моль молекул, моль атомов, моль ионов, подразумевая под этим NA молекул, атомов, ионов и соотв. их мол. массы, выраженные в граммах или килограммах. Традиционно употребляют в качестве синонима термин "молекулярный (молярный) вес", т. к. определение массы производится с помощью весов. Но, в отличие от веса, зависящего от географич. координат, масса является постоянным параметром количества вещества (при обычных скоростях движения частиц в условиях хим. реакций), поэтому правильнее говорить "молекулярная масса".
Большое число устаревших терминов и понятий, касающихся М. м., объясняется тем, что до эры космич. полетов в химии не придавали значения различию между массой и весом, которое обусловлено разностью значений ускорения своб. падения на полюсах (9,83 м∙с−2) и на экваторе (9,78 м∙с−2); при расчетах силы тяжести (веса) обычно пользуются средним значением, равным 9,81 м∙с−2. Кроме того, развитие понятия молекулы (как и атома) было связано с исследованием макроскопич. количеств вещества в процессах их хим. (реакции) или физ. (фазовые переходы) превращений, когда не была разработана теория строения вещества (19 в.) и предполагалось, что все хим. соед. построены только из атомов и молекул.
Методы определения. Исторически первый метод (обоснованный исследованиями С. Канниццаро и А. Авогадро) предложен Ж. Дюма в 1827 и заключался в измерении плотности газообразных веществ относительно водородного газа, молекулярная масса которого принималась первоначально равной 2, а после перехода к кислородной единице измерений молекулярных и атомных масс-2,016 г. След. этап развития эксперим. возможностей определения М.м. заключался в исследовании жидкостей и растворов нелетучих и недиссоциирующих веществ путем измерения коллигативных свойств (т. е. зависящих только от числа растворенных частиц) — осмотич. давления (см. осмометрия), понижения давления пара, понижения точки замерзания (криоскопия) и повышения точки кипения (эбулиоскопия) растворов по сравнению с чистым растворителем. При этом было открыто "аномальное" поведение электролитов.
Понижение давления пара над раствором зависит от молярной доли растворенного вещества (закон Рауля): [(р — р0)/р] = N, где р0-давление пара чистого растворителя, р-давление пара над раствором, N- молярная доля исследуемого растворенного вещества, N = (тх/Мх)/[(тх/Мх) + (m0/M0)], mx и Мх — соотв. навеска (г) и М.м. исследуемого вещества, m0 и М0-то же для растворителя. В ходе определений проводят экстраполяцию к бесконечно разб. раствору, т. е. устанавливают 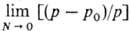 для растворов исследуемого вещества и для растворов известного (стандартного) хим. соединения. В случае криоскопии и эбулиоскопии используют зависимости соотв. Dt3 = Кс и Dtк = Еc, где Dt3-понижение температуры замерзания раствора, Dtк — повышение температуры кипения раствора, К и Е-соотв. криоскопич. и эбулиоскопич. постоянные растворителя, определяемые по стандартному растворенному веществу с точно известной М.м., с-моляльная концентрация исследуемого вещества в растворе (с = Мхтх∙1000/m0). М.м. рассчитывают по формулам: Мх = тхК∙1000/m0Dt3 или Мх = тхЕ∙1000/m0 Dtк. Методы характеризуются достаточно высокой точностью, т. к. существуют спец. термометры (т. наз. термометры Бекмана), позволяющие измерять весьма малые изменения температуры.
для растворов исследуемого вещества и для растворов известного (стандартного) хим. соединения. В случае криоскопии и эбулиоскопии используют зависимости соотв. Dt3 = Кс и Dtк = Еc, где Dt3-понижение температуры замерзания раствора, Dtк — повышение температуры кипения раствора, К и Е-соотв. криоскопич. и эбулиоскопич. постоянные растворителя, определяемые по стандартному растворенному веществу с точно известной М.м., с-моляльная концентрация исследуемого вещества в растворе (с = Мхтх∙1000/m0). М.м. рассчитывают по формулам: Мх = тхК∙1000/m0Dt3 или Мх = тхЕ∙1000/m0 Dtк. Методы характеризуются достаточно высокой точностью, т. к. существуют спец. термометры (т. наз. термометры Бекмана), позволяющие измерять весьма малые изменения температуры.
Для определения М.м. используют также изотермич. перегонку растворителя. При этом пробу раствора исследуемого вещества вносят в камеру с насыщ. паром растворителя (при данной температуре); пары растворителя конденсируются, температура раствора повышается и после установления равновесия вновь понижается; по изменению температуры судят о количестве выделившейся теплоты испарения, которая связана с М.м. растворенного вещества. В т. наз. изопиестич. методах проводят изотермич. перегонку растворителя в замкнутом объеме, напр. в Н-образном сосуде. В одном колене сосуда находится т. наз. раствор сравнения, содержащий известную массу вещества известной М. м. (молярная концентрация C1), в другом-раствор, содержащий известную массу исследуемого вещества (молярная концентрация C2 неизвестна). Если, напр., C1 > C2, растворитель перегоняется из второго колена в первое, пока молярные концентрации в обоих коленах не будут равны. Сопоставляя объемы полученных изопиестич. растворов, рассчитывают М.м. неизвестного вещества. Для определения М.м. можно измерять массу изопиестич. растворов с помощью весов Мак-Бена, которые представляют собой две чашечки, подвешенные на пружинках в закрытом стеклянном сосуде; в одну чашечку помещают исследуемый раствор, в другую-раствор сравнения; по изменению положения чашечек определяют массы изопиестич. растворов и, следовательно, М.м. исследуемого вещества.
Осн. методом определения атомных и мол. масс летучих веществ является масс-спектрометрия. Для исследования смеси соед. эффективно использование хромато-масс-спектромет-рии. При малой интенсивности пика мол. иона применяют эффузиометрич. приставки к масс-спектрометрам. Эффузио-метрич. способ основан на том, что скорость вытекания газа в вакуум из камеры через отверстие, диаметр которого значительно меньше среднего пути своб. пробега молекулы, обратно пропорциональна квадратному корню из М.м. вещества; скорость вытекания контролируют по изменению давления в камере. М.м. летучих соед. определяют также методами газовой хроматографии с газовыми весами Мартина. Последние измеряют скорость перемещения газа в канале, соединяющем трубки, по которым текут газ-носитель и газ из хроматографич. колонки, что позволяет определять разницу плотностей этих газов, зависящую от М.м. исследуемого вещества.
М. м. измеряют для идентификации хим. соед., для установления содержания отдельных нуклидов в соед., напр. в воде, используемой в атомных энергетич. установках, а также при исследовании и синтезе высокомол. соед., свойства которых существенно зависят от их М.м. (см. молекулярная масса полимера). Средние значения М.м. полимеров устанавливают с помощью перечисленных выше методов, основанных на коллигативных свойствах разбавленных растворов, по числу двойных связей ("мягким" озонолизом) или функц. групп (методами функцион. анализа), а также по таким свойствам их растворов, как вязкость, светорассеяние. Средние значения мол. масс полимеров высокой степени полимеризации определяют по их реологич. характеристикам.
Лит.: Рафиков С. Р., Павлова С. А., Твердохлебова И. И., Методы определения молекулярных весов и полидисперсности высокомолекулярныхсоединений, М., 1963; Полинг Л., Полинг П., Химия, пер. с англ., М., 1978; Вилков Л. В., Пентин Ю. А., Физические методы исследования в химии, М., 1987.
Ю. А. Клячко
Значения в других словарях
- МОЛЕКУЛЯРНАЯ МАССА — Значение массы молекулы, выраженное в атомных единицах массы. Практически М. м. равна сумме масс входящих в неё атомов (см. АТОМНАЯ МАССА). Физический энциклопедический словарь
- Молекулярная масса — Молекулярный вес, значение массы молекулы, выраженное в атомных единицах массы (См. Атомные единицы массы). Практически М. м. равна сумме масс всех атомов, входящих в состав молекулы; умножение М. Большая советская энциклопедия
- МОЛЕКУЛЯРНАЯ МАССА — МОЛЕКУЛЯРНАЯ МАССА (масса моля), термин ранее использовался для обозначения ОТНОСИТЕЛЬНОЙ МОЛЕКУЛЯРНОЙ МАССЫ. Научно-технический словарь
- МОЛЕКУЛЯРНАЯ МАССА — МОЛЕКУЛЯРНАЯ МАССА (молекулярный вес) — масса молекулы, выраженная в атомных единицах массы. Практически равна сумме масс всех атомов, из которых состоит молекула. Величины молекулярной массы используются в химических, физических и химико-технических расчетах. Большой энциклопедический словарь
