металлы
МЕТАЛЛЫ (от греч. metallon — первоначально, шахта, копи)
вещества, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К М. относятся как собственно М. (простые вещества), так и их сплавы, металлические соединения, в т. ч. интерметаллиды. Иногда М. наз. все вещества, обладающие теми или иными металлич. свойствами, напр. т. наз. "синтетические" М. (см. интеркалаты), металлы органические.
Ранее характерными признаками М. считались блеск, пластичность и ковкость — "светлое тело, которое ковать можно" (М. В. Ломоносов). Но металлич. блеском обладают и некоторые неметаллы, напр. иод. Известны хрупкие М., хотя мн. из них в результате тщательной очистки получены в пластичном состоянии. В настоящее время важнейшим признаком М. признается отрицат. температурный коэф. электрич. проводимости, т. е. понижение электрич. проводимости с ростом температуры. Из 109 элементов в периодич. системе 86 относят к М. Граница между М. и неметаллами в периодич. таблице (в ее длинном варианте) проводится по диагонали от В до At. О некоторых элементах, напр. Ge, Sb, нет единого мнения, все же правильнее считать Ge неметаллом, т. к. он обладает полупроводниковыми свойствами, a Sb-металлом, хотя по физ. свойствам сурьма -полуметалл.
Олово существует как в металлической (b-Sn), в полупроводниковой (a-Sn) модификации. С др. стороны, у Ge, Si, P и некоторых др. неметаллов при высоких давлениях обнаружены модификации с металлич. проводимостью. Можно предположить, что при достаточно высоких давлениях все вещества могут приобретать металлич. свойства. Поэтому вопрос об отнесении того или иного элемента к М. неметаллам следует, по-видимому, решать на основании рассмотрения не только физ. свойств простого вещества, но и его хим. свойств. Иногда для элементов, лежащих на границе между М. и неметаллами, применяют термин "полуметаллы", хотя этот термин в химии теперь не рекомендуется.
В М. существует металлическая связь, характеризующаяся тем, что кристаллич. решетка образована положит. ионами, тогда как валентные электроны делокализованы по всему пространству решетки. М. можно представить в виде остова из положит. ионов, погруженного в "электронный газ", который компенсирует силы взаимного отталкивания положит. ионов. Энергия этих делокализованных электронов-электронов проводимости — отвечает зоне проводимости. Согласно зонной теории, у М. отсутствует запрещенная зона между валентной зоной и зоной проводимости (см. твердое тело).
В кристаллах М. атомы ионизированы лишь частично и часть валентных электронов остается связанной, в результате возможно появление частично ковалентных связей между соседними атомами. Прочность связи в кристаллич. структуре М. характеризуется энтальпией атомизации, которая меняется от 61,4 кДж/моль у Hg до 850 кДж/моль у W. Макс. энтальпия атомизации характерна для М. рядов Nb-Ru и Hf-Ir. Относящиеся к ним М. отличаются макс. температурами плавления и высокой мех. прочностью.
Классификация М. Все М. делятся на четыре группы (см. форзац): s-М. (все s-элементы, кроме Н и Не), р-М. (элементы гр. IIIа, кроме В, а также Sn, Pb, Sb, Bi, Ро), d-M. и f-М., которые объединяются под назв. "переходных" (см. переходные элементы). М. первых двух групп иногда наз. "простыми". Из этих групп выделяются некоторые более узкие группы: из s-М. — щелочные металлы и щелочноземельные элементы, из d-M.- платиновые металлы. Группа редкоземельных элементов включает как d-, так и f-М. (подгруппа Sc и лантаноиды).
Существует также, хотя и не общепринятая, техн. классификация М. В известной мере она перекликается с геохимическими классификациями элементов. Обычно выделяют след. группы: черные М. (Fe); т я ж е л ы е ц в е т н ы е М.-Cu, Pb, Zn, Ni и Sn (к этой группе примыкают т. наз. малые, или младшие, М.-Со, Sb, Bi, Hg, Cd, некоторые из них иногда относят к редким М.); легкие М. (с плотностью менее 5 г/см3)-Al, Mg, Ca и т. д.; драгоценные M.-Au, Ag и платиновые М.; легирующие (или ферросплавные) М.-Mn, Cr, W, Mo, Nb, V и др.; редкие М. (см. редкие элементы), разбиваемые в свою очередь на неск. групп; радиоактивные M.-U, Th, Pu и др.
Кристаллическая структура. Большинство М. кристаллизуется в одном из трех структурных типов (см. металлические кристаллы), а именно — в кубич. и гексагон. плот-нейших упаковках (см. плотная упаковка) или в объем-ноцентрированной кубич. решетке. В плотнейших упаковках каждый атом на равных расстояниях имеет 12 ближайших соседей. В объемноцентрированной кубич. решетке у каждого атома 8 равноудаленных соседей, еще 6 соседей расположены на большем (на 15%) расстоянии. Поэтому координац. число в этой структуре считают равным 14 (8 + 6). Межатомные расстояния в кристаллич. структуре М. характеризуются металлич. радиусом (см. атомные радиусы).
При обычных-условиях щелочные М., а также Ва, Ra, элементы подгрупп V и Cr кристаллизуются в объемно-центрированной кубич. решетке типа a-Fe. Плотнейшая кубич. упаковка (гранецентрированная кубич. решетка) типа Cu характерна для Al, Ni, металлов подгруппы Cu, платиновых М. (кроме Ru и Os) и т. д. В гексагон. плотнейшей упаковке типа Mg кристаллизуются Be, Ca, Sr, Zn, Cd, Co, Ru, Os, элементы подгрупп Ti и Sc, мн. РЗЭ. Более сложными являются структуры разл. модификаций Mn, Ра, U, трансурановых элементов.
Мн. М. претерпевают при изменении температуры или давления полиморфные превращения. М., которые при низких температурах образуют плотнейшие упаковки, напр. Ca, La, Zr, часто имеют высокотемпературные модификации с объемноцентрированной кубич. структурой.
При плавлении М. сохраняют свои электрич., тепловые и оптич. свойства. Вблизи температуры плавления в жидких М. наблюдается примерно такой же ближний порядок, как и в кристаллич. М. С повышением температуры ближний порядок нарушается вплоть до полного разупорядочения.
Физические свойства. Физ. свойства М. меняются в очень широких пределах. Так, температура плавления изменяется от −38,87 °C (Hg) до 3380 °C (W), плотность — от 0,531 г/см3 (Li) до 22,5 г/см3 (Os). Уд. электрич. сопротивление р при 25 °C имеет значения от 1,63 (Ag) до 140 (Mn) мкОм∙см. Сопротивление движению электронов (рассеяние электронов) возникает вследствие нарушения кристаллич. решетки из-за теплового движения атомов, а также дефектов (вакансий, дислокаций, примесных атомов). Мерой его является длина своб. пробега электрона. При комнатной температуре она равна ~ 10−6 см у М. обычной чистоты и ~ 10−2 см у высокочистых. Температурный коэф. р (в интервале 0–100 °C) меняется в пределах 1,0∙10−3 (Hg)-9,0∙10−3 К−1 (Be). При гелиевых температурах (4,2 К) р практически не зависит от температуры (rост). Его измерение используют для характеристики чистоты и совершенства кристаллов М. Чем больше отношение r273/r4,2, тем чище М. В монокристаллах высокой чистоты оно достигает 104–105. Некоторые М. при низких температурах становятся сверхпроводниками, при этом критич. температура у чистых М. от сотых долей до 9 К.
У М. наблюдается термоэлектронная эмиссия (способность испускать электроны при высокой температуре). Эмиссия электронов возникает также под действием электромагн. излучения в видимой и УФ областях спектра (фотоэлектронная эмиссия), внеш. электрич. поля высокой напряженности (туннельная, или автоэлектронная, эмиссия), при бомбардировке поверхности М. электронами (вторичная электронная эмиссия) или ионами (ионно-электронная эмиссия), при взаимодействии поверхности М. с плазмой (взрывная электронная эмиссия). Перепад температуры вызывает в М. появление электрич. тока (термоэдс).
Теплопроводность М. обусловлена в осн. движением электронов, поэтому уд. коэф. теплопроводности (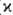 ) и электрич. проводимости (s) М. связаны между собой соотношением
) и электрич. проводимости (s) М. связаны между собой соотношением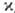 /(s•Т) = L = 2,45∙10−8 Вт∙Ом/К2 (закон Видемана — Франца). Уд. коэф. теплопроводности М. имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
/(s•Т) = L = 2,45∙10−8 Вт∙Ом/К2 (закон Видемана — Франца). Уд. коэф. теплопроводности М. имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
Температурный коэф. линейного расширения М. в интервале 0–100 °C имеет значения от 4,57∙10−6 (для Os) до 10−4 K−1 (для Sr). Согласно эмпирич. правилу Грюнайзена, относит. увеличение объема М. в интервале от О К до температуры плавления приблизительно равно 0,06. Поэтому температурный коэф. объемного расширения у тугоплавких М. меньше, чем у легкоплавких.
У большинства М. магн. восприимчивость по абс. величине сравнительно мала (~ 10−9) и слабо зависит от температуры. Среди М. есть диамагнетики, напр. Bi (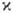 = — 1,34∙10−9), и парамагнетики, причем все переходные М., кроме металлов I и II гр., парамагнитны. Некоторые из них при температурах точки Кюри переходят в магнитно-упорядоченное состояние. М. триады Fe, а также Gd и некоторые др. лантаноиды — ферромагнетики, тогда как Cr, Mn, большинство лантаноидов-антиферромагнетики.
= — 1,34∙10−9), и парамагнетики, причем все переходные М., кроме металлов I и II гр., парамагнитны. Некоторые из них при температурах точки Кюри переходят в магнитно-упорядоченное состояние. М. триады Fe, а также Gd и некоторые др. лантаноиды — ферромагнетики, тогда как Cr, Mn, большинство лантаноидов-антиферромагнетики.
Излучения оптич. диапазона почти полностью отражаются поверхностью М., вследствие чего они непрозрачны и обладают характерным металлическим блеском (порошки мн. М. матовые). Некоторые М., например Au в виде тонкой фольги, просвечивают. Отраженный от поверхности М. плоскополяризованный свет становится эллиптически поляризованным.
Для использования М. в качестве конструкц. материалов важнейшее значение имеет сочетание мех. свойств — пластичности и вязкости с значит. прочностью, твердостью и упругостью. Эти свойства зависят не только от состава (чистоты металла), но и от совершенства кристаллич. решетки (наличия дефектов) и структуры, определяемых предварительной термич. и мех. обработкой образца.
Мех. свойства реальных М. определяются наличием дефектов, в первую очередь дислокаций, т. к. перемещение дислокаций по плоскостям кристаллич. решетки с наиб. плотной упаковкой является осн. механизмом пластич. деформации М. Взаимод. дислокаций с др. дефектами увеличивает сопротивление пластич. деформации. В процессе деформации число дислокаций растет, соотв. растет и сопротивление деформации (деформац. упрочнение, или наклеп). Напряженное состояние и наклеп после деформации ликвидируются при отжиге. Рост напряжений в местах "сгущения" дислокаций вызывает зарождение трещин — очагов разрушения. Важнейшая характеристика мех. свойств М. — модуль упругости Е (модуль Юнга). Предел текучести, т. е. сопротивление пластич. деформации, 10−3–10−4 Е.
Химические свойства. М. обладают низкими значениями первого потенциала ионизации и сродства к электрону. Вследствие этого в химических реакциях они выступают как доноры электронов (восстановители), а в соед. и их растворах образуют положительно заряженные ионы (в большинстве случаев аквакатионы). Электроотрицательности атомов М. ниже электроотрицательностей атомов неметаллов. М. могут входить в состав сложных анионов, напр. MnO−4, или ацидокомплексов, напр. [Fe(CN)6]4−, однако в них атомы М. всегда являются центрами положит. заряда. Только для некоторых М., находящихся на границе с неметаллами, таких, как Sn, Po, Sb и т. п., известны соед., напр. гидриды, в которых М. имеют формально отрицат. степень окисления. Но во всех этих соед. хим. связь ковалентная.
Способность М. к окислению меняется в очень широких пределах. Большинство М. окисляется кислородом воздуха уже при обычной температуре, однако скорость и механизм реакции очень сильно зависят от природы М. В большинстве случаев при этом образуются оксиды, а у щелочных М., кроме Li,-пepоксиды. Устойчивость М. на воздухе определяется свойствами образующегося оксида, в частности отношением молярных объемов Vокс/VM.. Если Vокс/VМ. > 1, на М. образуется защитная пленка, предохраняющая М. от дальнейшего окисления. Такая пленка характерна, напр., для Al, Ti, Cr, которые устойчивы на воздухе, хотя и обладают высокой активностью. М., для которых это отношение меньше 1 (напр., щелочные), на воздухе неустойчивы.
СN2 реагирует ряд М., напр. Li при обычной температуре , a Mg, Zr, Hf, Ti — при нагревании. Мн. М. активно взаимод. с H2, галогенами, халькогенами. Все М., чьи стандартные электродные потенциалы отрицательнее, чем —0,413 В, окисляются водой с выделением H2. Щелочные и щел.-зем. М. реагируют с водой при обычных температурах, а такие М., как Zn или Fe, реагируют с водяным паром при высоких температурах. С растворами щелочей взаимод. М., образующие растворимые анионные гидроксокомплексы (Be, Zn, Al, Ga, Sn).
Большинство М. окисляется теми или иными кислотами. М., имеющие отрицат. стандартные электродные потенциалы, т. е. стоящие в электрохимическом ряду напряжений до водорода, окисляются ионами H+ и растворяются поэтому при действии неокисляющих кислот (соляная или разб. H2SO4), если не образуются нер-римые продукты. Реакции способствует образование анионных комплексов. Азотная кислота, даже разбавленная, окисляет мн. М. При этом, если ионы М. устойчивы в низших степенях окисления, образуются катионные комплексы, если в высших, как в случае, напр., Re,-анионные (ReO−4 ). Некоторые М. реагируют с разб. HNO3 и H2SO4 с образованием катионных комплексов и пас-сивируются в конц. растворах этих кислот. Для растворения малоактивных М., напр. Au или Pt, используют смеси, содержащие окислитель и поставщик лигандов для образования растворимых комплексов, таких, как, напр., царская водка или смесь HNO3 с HF.
О взаимод, М. со средой, ведущем к разрушению М., см. в ст. коррозия металлов.
Важная характеристика металлич. элементов-их способность образовывать основные оксиды и соотв. гидроксиды. У М. главных подгрупп периодич. системы основность оксидов и гидроксидов растет сверху вниз, в побочных подгруппах (кроме I — III) — обратная зависимость. По периодам и рядам с ростом порядкового номера элемента основность убывает. У М., имеющих неск. степеней окисления, как d- и f-М., с ростом степени окисления основность оксидов уменьшается и высшие оксиды имеют кислотный характер.
Получение М. Извлечение М. из прир. сырья и др. источников — область металлургии. Можно отметить двоякий характер технологии М. Технология железа, тяжелых цветных М., а также малых М. и большинства рассеянных элементов (халькофильных элементов) имеет "металлур-гич." характер. Это означает, что конечный продукт получают без предварит. выделения к.-л. чистого соединения, что обусловлено сравнит. легкостью восстановления до М. как пирометаллургич. (см. пирометаллургия), так и гидрометаллургич. (электролиз растворов, цементация и т. п.; см. гидрометаллургия) путем.
Иной характер имеет технология легких, а также редких М. (литофильных элементов). Это связано с трудностями их получения в своб. состоянии. Для этих М. технология разбивается четко на два этапа — получение чистого соед., напр. Al2O3, и получение М. из этого соединения. Сами М. в производстве их соед. обычно не используют. Поэтому можно сказать, что технология этих М. имеет более "химический" характер.
Способность М. к взаимному растворению с образованием при кристаллизации твердых растворов и интерметал-лидов, разнообразным фазовым превращениям дает возможность получения большого числа сплавов, отличающихся разл. структурой и самыми разнообразными сочетаниями свойств. В совр. технике применяют св. 30 000 разл. сплавов — легкоплавких и тугоплавких, очень твердых и пластичных, с большой и малой электрич. проводимостью, ферромагнитных и др. В сплавах ныне используют практически все известные М. (кроме искусственно полученных трансплутониевых элементов). Мера использования в значит. степени определяется доступностью М. — содержанием в земной коре, а также степенью концентрирования в месторождениях и трудностью получения. Использование сплавов (бронзовый век) было одним из важнейших этапов становления человеческой цивилизации. И в настоящее время сплавы-важнейшие конструкционные материалы. В последние годы наблюдается тенденция некоторого снижения роли железа и увеличение использования легких М. (Al, Mg) и наиб. доступных редких М. (Ti, Nb, Zr).
Лит.: Пирсон У., Кристаллохимия и физика металлов и сплавов, пер. с англ., ч. 1–2, М., 1977; Уманский Я. С., Скаков Ю.А., Физика металлов. Атомное строение металлов и сплавов, М., 1978; Бернштейн М.Л., Зай-мовский В. А., Механические свойства металлов, 2 изд., М., 1979; Лившиц Б. Г., Крапошин В. С., Липецкий Я. Л., Физические свойства металлов и сплавов, 2 изд., М., 1980; Баррет Ч. С., Массальский Т. Б., Структура металлов, пер. с англ., ч. 1–2, М., 1984; Гуляев А. П., Металловедение, 6 изд., М., 1986; Зайцев Б. Е., Общие физические и химические свойства металлов, М., 1987; Пекшева Н. П., Химия металлов, Красноярск, 1987; Абрикосов А. А., Основы теории металлов, М., 1987; Бобылев А. В., Механические и технологические свойства металлов, 2 изд., М., 1987.
П. И. Федоров
Значения в других словарях
- МЕТАЛЛЫ — (от греч. metallon, первоначально — шахта, руда, копи), простые в-ва, обладающие в обычных условиях характерными св-вами: высокими электропроводностью и теплопроводностью, отрицательным температурным коэфф. Физический энциклопедический словарь
- Металлы — Простые вещества, обладающие в обычных условиях характерными свойствами: высокой электропроводностью и теплопроводностью, отрицательным температурным коэффициентом электропроводности... Большая советская энциклопедия
- Металлы — В Свящ. Писании нередко упоминаются из металлов: железо, медь, олово, свинец, цинк, серебро, золото. (См. о каждом в своем месте). Библейская энциклопедия архим. Никифора
- МЕТАЛЛЫ — МЕТАЛЛЫ, химические элементы, обладающие высокой тепло- и электропроводностью, атомы которых связаны в кристаллические решетки единственным в своем роде способом. Смеси таких элементов (СПЛАВЫ) также являются металлами. Научно-технический словарь
- МЕТАЛЛЫ — В качестве элемента мифопоэтической системы М. могут функционировать в нескольких аспектах. Иногда (обычно в более поздних традициях) они образуют особый «металлический» код из 3-7 единиц... Мифологическая энциклопедия
- Металлы — I (и металлоиды) (хим.) — М. называется группа простых тел (см.), обладающих известными характерными свойствами, которые в типических представителях резко отличают М. от других химических элементов. Энциклопедический словарь Брокгауза и Ефрона
- МЕТАЛЛЫ — МЕТАЛЛЫ (греч.) — вещества, обладающие в обычных условиях высокими электропроводностью (106-107 Ом-1 см-1, уменьшается с ростом температуры) и теплопроводностью, ковкостью, "металлическим" блеском и др. Большой энциклопедический словарь
