магнийорганические соединения
МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь Mg—С Осн. типы M.c. — R2Mg, RMgX, где X = Hal, OR, SR, NRR'. Наиб. важны RMgHal (Hal = Cl, Br, I), наз. реактивами Гриньяра, — бесцветные кристаллы или вязкие жидкости состава Mg : R : Hal = 1 : 1 : 1; устойчивы до 100–150 °C. Получают и используют их гл. обр. в эфирном растворе. Эфир полностью обычно не удаляется, и RMgHal, доведенные до постоянного веса в вакууме при 100 °C, представляют собой смесь MgHal2 и [R2Mg]n; в твердом виде выделяются как комплексы с растворителем состава 1:1 или 1:2. RMgHal, полученные в углеводородах, дают осадок MgHal2 и растворимое металлоорг. вещество, которое в твердом виде отвечает составу R3Mg2Hal. В растворе RMgHal существует равновесие Шленка, смещенное влево: 2RMgHal ⇄ MgHal2 + R2Mg. Стехиометрич. смесь MgHal2 и R2Mg в эфире дает продукт, полностью идентичный RMgHal. Полагают, что в равновесии Шленка участвуют сольватир. комплексы, напр.:
R2Mg.2ТГФ + MgHal2∙4ТГФ ⇄ 2(RMgHal.nТГФ) + mТГФ (п = 2, 3, т = 0–2);
R2Mg∙2(C2H5)2O + MgHal2∙2(C2H5)2O ⇄ 2[RMgHal∙2(C2H5)2O]
В гексаметаполе (L) главная форма — RMgHal.2L с частично ионной связью Mg—С. В углеводородах RMgHal образуют структуры с мостиковыми атомами галогена, RMgF в эфире и ТГФ — димер с мостиковыми атомами F. Соед. RMgHal разлагаются выше 100 °C по типу β-элиминирования, напр.: 2RCH2CH2MgHal : 2RCH=CH2 + MgH2 + MgHal2. Окисление RMgHal первоначально приводит к ROOMgHal, затем образуются ROMgHal. При действии орг. соед. с активным атомом водорода RMgHal дают RH. Эту реакцию (при R = CH3) используют для определения активного Н в орг. соед. (см. Церевитинова метод). М.с. RMgHal разлагаются под действием воды и кислот, восстанавливаются H2 при нагр. до RH, MgH2 и MgHal2. С галогенами образуют RHal и MgHal2, с S (и послед. гидролизом) — RSH, с SO2 — RSO2MgHal2, с CO2 — соли карбоновых кислот. С солями др. металлов реагируют по схеме:
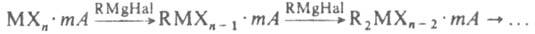
(А — растворитель). Это осн. метод синтеза металлоорг. соед. переходных и непереходных металлов с σ-связью металл-элемент. Реакции способствуют более полярные растворители. В обычных условиях RMgHal не присоединяются к несопряженным алкенам и алкинам. При высоких температуре и давлении RMgHal присоединяются к терминальным алкенам, сопряженным алкенам и алкинам, что используют как стадию в орг. синтезе. О наиб. важных реакциях RMgHal с соед., содержащими связи C=O,  , C=S и др., см. Гриньяра реакция, Иоцича реакция. Соед. R2Mg — бесцв. твердые вещества, обычно разлагающиеся при нагр. без плавления, для некоторых R2Mg известны температуры плавления. Плохо раств. в насыщ. углеводородах, лучше — в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с растворителем составов 1:1 или 1:2, однако в отличие от RMgHal растворитель м. б. легко удален в вакууме. В кристаллич. состоянии R2Mg(R = CH3, C2H5) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2Mg представляют собой димеры или тримеры, в эфире или ТГФ — сольватированные мономеры, однако при высоких концентрациях R2Mg возможна их ассоциация. Связь Mg—С в растворенных R2Mg обычно ковалентная, однако в гексаметаполе она существенно ионизирована. В эфирном растворе (C5H5)2Mg существует как контактная ионная пара. Наиб. термически стабильно соед. [(CH3)2Mg]n, которое разлагается выше 220 °C с выделением CH4 и образованием полимерного (CH2Mg)n. Выше 300 °C при разложении образуются H2 и MgC2. Др. R2Mg, где R — нормальный алкил, разлагаются при 170–210 °C до MgH2 и алкенов, при R = вторичный и третичный алкил — при более низких температурах. По химическим свойствам R2Mg в целом аналогичны RMgHal, однако часто хим. реакции R2Mg протекают с большими скоростями. Таковы, напр., реакции с O2, CO2, H2, реакции с орг. соед. и др. Однако наблюдаются и некоторые различия. Например, 1,2-присоединения R2Mg к α,β-ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение. Получают R2Mg: осаждением диоксаном из эфирного раствора RMgHal; реакцией с ртутьорг. соед. — R2Hg + Mg → R2Mg + Hg; (C5H5)2Mg м. б. получен при 500 °C из C5H6 и металлич. Mg. Соед. типа RMgOR' — кристаллы, нелетучи; плохо раств. в насыщ. углеводородах, раств. в ароматич. растворителях. Образуют комплексы с эфиром, из которых он легко удаляется в вакууме. В твердом состоянии представляют собой линейные олигомеры, в растворе образуют ассоциаты с мостиковыми атомами О. При пиролизе RMgOR' при 200–340 °C образуются алканы, алкены и MgO. Присоединяются к группе C=O альдегидов и кетонов, но менее легко, чем R2Mg, давая большее количество побочных продуктов. Получают их алкоголизом R2Mg. Соед. типа RMgX, где X = SR, NRR', получают действием RSH или RR'NH на R2Mg в эфире при низких температурах. М.с., образованные путем переноса электрона от Mg к ароматич. и др. ненасыщ. системам, менее изучены по сравнению с аналогичными соед. щелочных металлов. М.с. в осн. используют в орг. синтезе и для получения металлоорг. соединений. В промышленности М.с. в смеси с др. металлоорг. соед. применяют как катализаторы полимеризации.
, C=S и др., см. Гриньяра реакция, Иоцича реакция. Соед. R2Mg — бесцв. твердые вещества, обычно разлагающиеся при нагр. без плавления, для некоторых R2Mg известны температуры плавления. Плохо раств. в насыщ. углеводородах, лучше — в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с растворителем составов 1:1 или 1:2, однако в отличие от RMgHal растворитель м. б. легко удален в вакууме. В кристаллич. состоянии R2Mg(R = CH3, C2H5) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2Mg представляют собой димеры или тримеры, в эфире или ТГФ — сольватированные мономеры, однако при высоких концентрациях R2Mg возможна их ассоциация. Связь Mg—С в растворенных R2Mg обычно ковалентная, однако в гексаметаполе она существенно ионизирована. В эфирном растворе (C5H5)2Mg существует как контактная ионная пара. Наиб. термически стабильно соед. [(CH3)2Mg]n, которое разлагается выше 220 °C с выделением CH4 и образованием полимерного (CH2Mg)n. Выше 300 °C при разложении образуются H2 и MgC2. Др. R2Mg, где R — нормальный алкил, разлагаются при 170–210 °C до MgH2 и алкенов, при R = вторичный и третичный алкил — при более низких температурах. По химическим свойствам R2Mg в целом аналогичны RMgHal, однако часто хим. реакции R2Mg протекают с большими скоростями. Таковы, напр., реакции с O2, CO2, H2, реакции с орг. соед. и др. Однако наблюдаются и некоторые различия. Например, 1,2-присоединения R2Mg к α,β-ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение. Получают R2Mg: осаждением диоксаном из эфирного раствора RMgHal; реакцией с ртутьорг. соед. — R2Hg + Mg → R2Mg + Hg; (C5H5)2Mg м. б. получен при 500 °C из C5H6 и металлич. Mg. Соед. типа RMgOR' — кристаллы, нелетучи; плохо раств. в насыщ. углеводородах, раств. в ароматич. растворителях. Образуют комплексы с эфиром, из которых он легко удаляется в вакууме. В твердом состоянии представляют собой линейные олигомеры, в растворе образуют ассоциаты с мостиковыми атомами О. При пиролизе RMgOR' при 200–340 °C образуются алканы, алкены и MgO. Присоединяются к группе C=O альдегидов и кетонов, но менее легко, чем R2Mg, давая большее количество побочных продуктов. Получают их алкоголизом R2Mg. Соед. типа RMgX, где X = SR, NRR', получают действием RSH или RR'NH на R2Mg в эфире при низких температурах. М.с., образованные путем переноса электрона от Mg к ароматич. и др. ненасыщ. системам, менее изучены по сравнению с аналогичными соед. щелочных металлов. М.с. в осн. используют в орг. синтезе и для получения металлоорг. соединений. В промышленности М.с. в смеси с др. металлоорг. соед. применяют как катализаторы полимеризации.
Лит.: Общая органическая химия, пер. с англ., т. 7, М., 1984. с. 42–59; Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. I, Oxf, 1982, p. 156–223.
А. С. Перегудов
Значения в других словарях
- Магнийорганические соединения — Соединения, содержащие связь углерод — магний. Известны два типа М. с.: полные — магнийдиалкилы или магнийдиарилы R2Mg и смешанные — алкил- или арилмагнийгалогениды RMgX (X = Cl, Br, I). Полные М. Большая советская энциклопедия
- МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле атом магния, непосредственно связанный с атомом углерода. Известны магнийорганические соединения типа R2Mg и RMgX, где R — органический радикал, Х — галоген. Применяются для получения других металлоорганических и различных органических соединений. Большой энциклопедический словарь
