давление
ДАВЛЕНИЕ
физ. величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с которыми одно тело действует на поверхность другого. Д. — один из основных параметров состояния термодинамич. системы, входящий в уравнения состояния (вместе с температурой и уд. объемом). При равномерном распределении сил вдоль поверхности Д. р определяется как сила F, действующая по нормали к поверхности на площадь S: р = F/S. Если распределение сил по поверхности неравномерно, рассматривают Д. в данной точке:
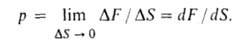
Единица Д. в системе СИ-паскаль (Па); 1 Па = 1 Н/м2. В качестве единиц Д. используют также бар, атмосферу и кгс/см2; 0,1 МПа =1 бар = 1,0197 кгс/см2 = 0,98692 атм. Нормальное Д.-101325 Па.
При сжатии газов и жидкостей прилагаемая нагрузка распределяется в веществе изотропно, т. е. Д. по всем направлениям одинаково (гидростатич. Д.). При сжатии твердых тел возникающие в объеме тела напряжения обычно распределяются неравномерно. В этом случае под Д. в данной точке понимают среднее арифметическое нормальных напряжений, действующих в трех взаимно перпендикулярных направлениях.
Д. условно делят на низкие, умеренные, высокие и сверхвысокие. Диапазон Д., наз. высокими, различен в разных областях науки и техники. В химии обычно высокими считают Д. свыше 100 МПа. Различают статические Д., существующие при длительных режимах сжатия, и динамические, действующие кратковременно, напр. при взрыве. Диапазон высоких Д., встречающихся в природе, весьма широк. Статич. Д., обусловленное гравитационным полем Земли, достигает в глубинах океана 100 МПа, в центре Земли-360 ГПа. На звездах (белые карлики) статич. Д. составляет 1010–1012 ГПа. В промышленности освоены статич. Д. 6–8 ГПа, в лаб. условиях достигнуто Д. 170 ГПа. Сжатие вещества в статическом режиме может осуществляться при высоких температурах (~ 3000 К), а также при дополнительном наложении напряжений сдвига, вызывающих пластическую деформацию. Динамич. Д., при которых выполняются физ.-хим. исследования конденсированных систем, достигают 500 ГПа.
Д. до 1 ГПа обычно измеряют манометрами, свыше 1 ГПа-датчиками из сплавов металлов (напр., манганина), электрическое сопротивление которых зависит от Д.
Сведения о влиянии высоких Д. на физ.-хим. свойства веществ появились в 19 в. Систематич. изучение поведения веществ при высоких Д. было начато в 20-х гг. 20 в. Основополагающие результаты в этой области были получены П. Бриджменом. В СССР аналогичные исследования были начаты в 30-е гг. Важную роль в развитии исследований физ. и хим. процессов сыграли работы Л. Ф. Верещагина с сотр. В данной статье рассматривается действие на вещество статич. Д.; о физ.-хим. исследованиях при динамич. Д. см. в ст. взрыв, ударных труб метод.
Влияние Д. на физ. свойства веществ. Непосредственным результатом действия Д. является сжатие вещества, т. е. изменение его объема вследствие изменения межатомных (межмолекулярных) расстояний. Способность вещества изменять свой объем под действием Д. характеризуется сжимаемостью. С увеличением Д. плотность газов растет и при Д. порядка сотен МПа приближается к плотности жидкостей. При 1 ГПа плотность большинства жидкостей возрастает на 20–30% по сравнению с плотностью при нормальном Д. Для многих металлов при 10 ГПа плотность возрастает на 6–15%, для др. твердых тел-на 15–25%. Изменение объема жидкости или сильно сжатого газа в интервале Д. от некоторого начального р0 до значения р м. б. описано уравнением Тейта:
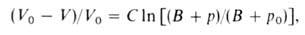
где V0 и V-объем вещества при Д. р0 и р соотв., С и В-эмпирич. постоянные.
Вязкость жидкостей увеличивается с Д. (см. рис. 1). Ди-электрич. проницаемость вещества обычно возрастает с Д., что обусловлено в основном изменением плотности. Для многих веществ зависимость
вещества обычно возрастает с Д., что обусловлено в основном изменением плотности. Для многих веществ зависимость от Д. удовлетворительно описывается уравнением:
от Д. удовлетворительно описывается уравнением:
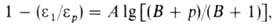
где и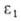 -диэлектрич. проницаемость при давлении р и 1
-диэлектрич. проницаемость при давлении р и 1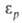 атм, А и В-эмпирич. постоянные. Температуры плавления tпл подавляющего большинства веществ повышаются с Д. (см. рис. 2). Исключения-вода, Bi, Ga, Ge и некоторые другие вещества, плотность которых в твердой фазе ниже, чем в жидкой. Однако и у этих веществ по достижении Д. перехода твердой фазы с низкой плотностью в др. кристаллич. модификацию с плотностью большей, чем у жидкости, начинается рост tпл с Д. Для описания зависимости tпл от Д. широко используют уравнение Саймона:
атм, А и В-эмпирич. постоянные. Температуры плавления tпл подавляющего большинства веществ повышаются с Д. (см. рис. 2). Исключения-вода, Bi, Ga, Ge и некоторые другие вещества, плотность которых в твердой фазе ниже, чем в жидкой. Однако и у этих веществ по достижении Д. перехода твердой фазы с низкой плотностью в др. кристаллич. модификацию с плотностью большей, чем у жидкости, начинается рост tпл с Д. Для описания зависимости tпл от Д. широко используют уравнение Саймона:
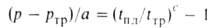
где ртр и tтр-давление и температура тройной точки вещества, а и с-эмпирич. постоянные.
Под Д. твердые тела нередко претерпевают полиморфные переходы. Так, при 20 °C и 5,5 ГПа Ba с кубич. объемноцентрированной решеткой переходит в гексагональную модификацию типа Mg. Другие примеры-фазовые переходы Т1 при 3,7 ГПа, KCl при 2 ГПа, AgCl при 9 ГПа, нафталина при 2,5 ГПа. При температурах > 1300 К и давлениях >4 ГПа наблюдается переход графит-алмаз; тройная точка алмаз-графит-расплав соответствует 3000 К и 12,4 ГПа. При Д. свыше 100 ГПа предполагается существование фазового перехода твердого водорода с образованием структуры, построенной из атомов и обладающей металлич. свойства-ми. У орг. веществ при изменении Д. обнаруживается обычно больше полиморфных переходов, чем у неорганических.
Растворимость в жидкостях газов и их смесей (при условии, что они близки по своему поведению к идеальным газам) с ростом Д. увеличивается (см. Генри закон, Дальтона законы). Влияние Д. на растворимость тел зависит от того, как изменяется с Д. молярный объем вещества и его парциальный молярный объем в растворе. Если при некотором Д. молярный объем вещества становится меньше его парциального молярного объема, растворимость вещества, в соответствии с Ле Шателье Брауна принципом, с ростом Д. снижается. Такая закономерность характерна для реальных газов и твердых тел в случае неполярных растворителей. Например, при 500 МПа растворимость гексахлорэтана и SnI4 в CS2 уменьшается по сравнению сих растворимостью при 0,1 МПа в 15 и в 7,5 раза соотв. Для газов с ограниченной растворимостью в жидкости характерно наличие максимума на кривой зависимости растворимости от Д. Если вещество при растворении диссоциирует на ионы, то при оценке влияния Д. дополнительно следует учитывать изменение молярного объема в результате сольватации ионов молекулами растворителя.
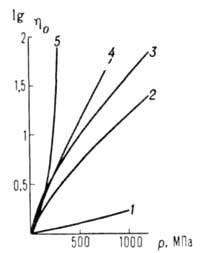
Рис. 1. Зависимость относительной вязкости (
( -вязкость при 1 атм) от давления р для различных жидкостей. 1 — вода, 2 — этанол, 3 — пентан, 4 — глицерин, 5 — эвгенол
-вязкость при 1 атм) от давления р для различных жидкостей. 1 — вода, 2 — этанол, 3 — пентан, 4 — глицерин, 5 — эвгенол
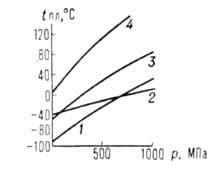
Рис. 2. Зависимость температуры плавления tпл от давления р для различных веществ. 1 ацетон, 2 ртуть, 3 хлорбензол, 4 — бензол.
При высоких Д. возможно расслоение гомогенной газовой смеси на две фазы при температурах, превышающих критич. температуры компонентов смеси. Этот эффект был экспериментально обнаружен И. Р. Кричевскимссотр. в 1941–43 (см. критическое состояние).
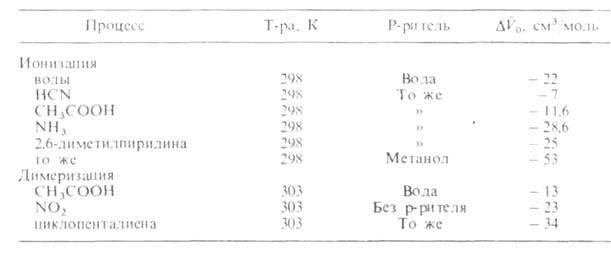
Влияние Д. на хим. реакции. При сжатии газовых реакц. смесей в области Д., ограниченных десятками МПа, наблюдается увеличение скорости реакций и смещение хим. равновесия. Это объясняется гл. обр. изменением концентраций реагирующих веществ (см. действующих масс закон). Для веществ в конденсированной фазе или для газов при Д. выше 200–300 МПа повышение концентрации реагентов с ростом Д. невелико, тем не менее многие процессы чувствительны к Д. Так, Д. существенно влияет на равновесие электролитич. диссоциации кислот и оснований, изменяет концентрацию комплексов с переносом заряда, влияет на равновесие кето-енольной таутомерии, на конформац. равновесие, смещает равновесие мономер-полимер и т. д. Под Д. удается осуществить полимеризацию веществ, для которых равновесие мономер-полимер при атмосферном Д. смещено в сторону мономера.
Для идеальных газовых смесей зависимость константы равновесия KХ(Т, р)(концентрации реагирующих веществ выражены в молярных долях х) от Д. при постоянной температуре Т выражается уравнением:
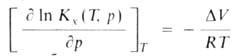
где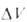 -изменение объема системы вследствие хим. реакции, R-газовая постоянная. Влияние Д. на KХ(Т, р)определяется знаком
-изменение объема системы вследствие хим. реакции, R-газовая постоянная. Влияние Д. на KХ(Т, р)определяется знаком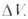 При
При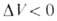 Д. смещает равновесие в сторону продуктов реакции. Для реакций в конденсированной фазе влияние Д. на KХ(Т, р)описывается уравнением:
Д. смещает равновесие в сторону продуктов реакции. Для реакций в конденсированной фазе влияние Д. на KХ(Т, р)описывается уравнением:
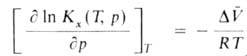
где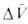 -изменение парциального молярного объема в результате реакции, равное разности между парциальными моляоными объемами исходных веществ
-изменение парциального молярного объема в результате реакции, равное разности между парциальными моляоными объемами исходных веществ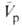 и продуктов
и продуктов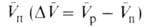 Величина
Величина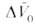 , получаемая экстраполяцией опытных данных к р = 1 атм, наз. объемным эффектом реакции. При
, получаемая экстраполяцией опытных данных к р = 1 атм, наз. объемным эффектом реакции. При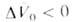 Д. смещает равновесие в сторону продуктов реакции. Значения
Д. смещает равновесие в сторону продуктов реакции. Значения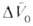 для некоторых реакций приведены в табл. 1.
для некоторых реакций приведены в табл. 1.
Табл. 1 — ОБЪЕМНЫЕ ЭФФЕКТЫ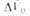 НЕК-РЫХ Р-ЦИЙ
НЕК-РЫХ Р-ЦИЙ
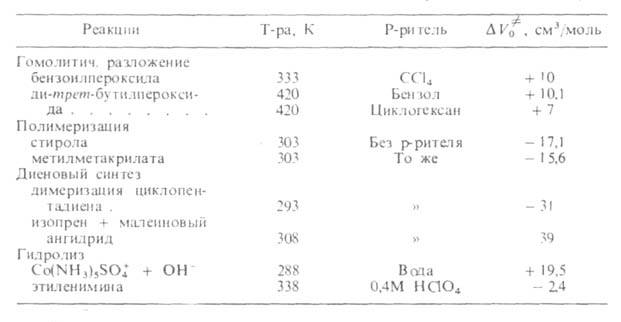
Скорости реакций по-разному изменяются с Д. (см. рис. 3). Бимолекулярные реакции обычно ускоряются с Д., мономолекулярные-замедляются. Так, скорость диенового синтеза при повышении Д. до 1000 МПа может возрастать в тысячи раз, а реакции распада обычно затормаживаются. Согласно активированного комплекса теории, зависимость от Д. константы скорости элементарной реакции к (Т, р)при постоянной температуре определяется изменением молярного объема реагентов при образовании активированного комплекса
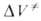
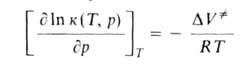
(концентрации реагентов выражены моляльностями). Если полярность активированного комплекса отличается от полярности молекул реагентов, то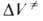 складывается из двух объемных эффектов:
складывается из двух объемных эффектов: 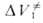 , обусловленного изменением молярного объема самих реагентов, и
, обусловленного изменением молярного объема самих реагентов, и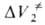 , обусловленного перестройкой сольватных оболочек реагирующих частиц в момент образования активированного комплекса.
, обусловленного перестройкой сольватных оболочек реагирующих частиц в момент образования активированного комплекса.
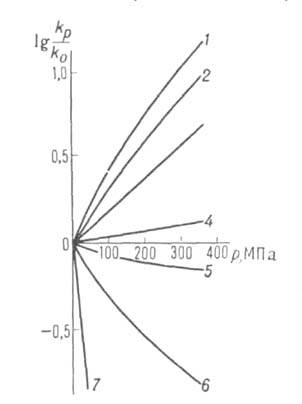
Рис. 3. Зависимость константы скорости kp от давления р для различных реакций (k0-константа скорости реакции при 1 агм). 1 — димеризация циклопентадиена (293 К); 2 — полимеризация метилметакрилата (313 К); 3 — нитрование толуола (273 К); 4 — гидролиз этиленимина (338 К); 5 — распад 2,2-азо-бис-изобутиронитрила (313 К); 6 — гидролиз Co(NH3)5SO4+ + OH- (288 К).
Величина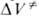 изменяется с Д., поэтому график зависимости In к от р, как правило, не является прямой линией. Для описания зависимости In к от р нередко используют степенные функции, напр.:
изменяется с Д., поэтому график зависимости In к от р, как правило, не является прямой линией. Для описания зависимости In к от р нередко используют степенные функции, напр.:
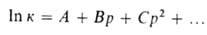
где А, В, С-эмпирич. постоянные.
Для диенового синтеза зависимость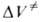 от р удовлетворительно описывается уравнением Тейта при подстановке в это уравнение вместо V и V0 значений
от р удовлетворительно описывается уравнением Тейта при подстановке в это уравнение вместо V и V0 значений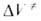 и
и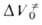 соотв. Величина
соотв. Величина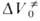 , равная
, равная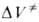 при р = 1 атм, имеет важное теоретич. значение, поскольку в ряде случаев она позволяет СУДИТЬ о строении активированного комплекса. Значения
при р = 1 атм, имеет важное теоретич. значение, поскольку в ряде случаев она позволяет СУДИТЬ о строении активированного комплекса. Значения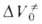 изменяются в широких пределах в зависимости от типа реакции (табл. 2). В случае сложной реакции связь
изменяются в широких пределах в зависимости от типа реакции (табл. 2). В случае сложной реакции связь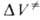 для реакции в целом со значениями
для реакции в целом со значениями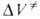 для элементарных стадий зависит от конкретного механизма процесса. Например, для радикальной полимеризации
для элементарных стадий зависит от конкретного механизма процесса. Например, для радикальной полимеризации
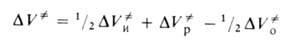 >
>
где индексы "и", "р" и "о" относятся соотв. к инициированию, росту и обрыву полимерных цепей.
Табл. 2 ОБЪЕМНЫЕ ЭФФЕКТЫ АКТИВАЦИИ НЕК-РЫХ Р-ЦИЙ
АКТИВАЦИИ НЕК-РЫХ Р-ЦИЙ
Изменение скорости хим. процессов м. б. обусловлено также влиянием Д. на физ. свойства среды. Так, вследствие возрастания вязкости с повышением Д. реакции могут перейти из кинетич. области протекания в диффузионную, когда скорость реакции контролируется диффузией реагирующих частиц (см. макрокинетика). Изменяя е среды, Д. влияет на скорость ионных реакций. При этом объемные эффекты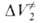 , вызванные сольватацией ионов или заряженных групп молекул, учитываются с помощью уравнения Друде — Нернста — Борна:
, вызванные сольватацией ионов или заряженных групп молекул, учитываются с помощью уравнения Друде — Нернста — Борна:
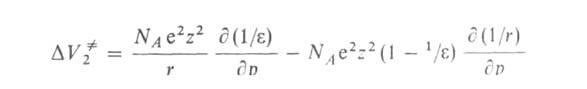
где NA — постоянная Авогадро, r и z-радиус и зарядовое число иона соотв.
Хим. взаимод. в твердой фазе обычно замедляется с ростом Д. Для интенсификации твердофазных реакций (синтез минералов, полимеризация и др.) их проводят при высоких температурах.
Взаимодействие твердых веществ под Д. резко усиливается, если реагенты подвергаются пластич. деформации сдвига. В этих условиях реализуются многие твердофазные хим. процессы: полимеризация, нуклеоф. присоединение аммиака, воды, карбоксильной группы к связи C=C, синтез амидов и пептидов, разложение пероксидов, карбонилов и оксидов металлов, неорганич. солей, реакции этерификации и др. Ароматич. соед. при деформации под Д. нередко претерпевают превращения, сопровождающиеся разрывом цикла:
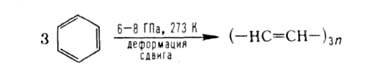
Скорости хим. реакций при одновременном действии высоких Д. и деформаций сдвига очень велики и могут превосходить скорости соответствующих жидкофазных процессов при тех же Д. и температурах в миллионы и более раз. Реакционная способность твердых веществ (константы скорости, выходы продуктов) в значит. степени зависят от физ. свойств среды (пластичности, предельного напряжения сдвига, кристаллич. структуры). Как правило, реакционная способность вещества возрастает, если его деформировать в смеси с пластичным веществом, обладающим напряжением сдвига большим, чем у чистого реагента. В условиях деформации выход продуктов реакции является функцией деформации сдвига (при постоянных Д. и температуре) и в широких пределах не зависит от времени деформирования реакционной смеси (рис. 4). Время деформирования м. б. очень малым и исчисляться долями с. Зависимость выхода продуктов от деформации сдвига удается описать в ряде случаев (напр., при полимеризации акриламида) методами формальной кинетики при замене в дифференц. уравнениях времени на деформацию сдвига.
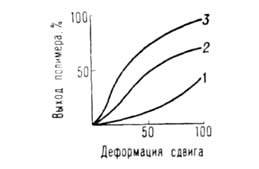
Рис. 4. Зависимость выхода полимера (в %) от деформации сдвига (полимеризация при 2 ГПа) (293 К). 1 — малеиновый ангидрид, 2 — метакриламид, 3 — акриламид.
Биохимич. эффекты высоких Д. При Д. в неск. сотен МПа происходит денатурация белков, при этом меняются их антигенные свойства, снижается активность токсинов. Особенно чувствительны к Д. процессы образования связей белок-лиганд и белок-белок. Так, для белков характерно значит. уменьшение скорости ассоциации с повышением Д. (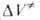 положительны и могут исчисляться сотнями см3/моль). Денатурирующее влияние Д. зависит от природы белка, температуры и pH среды. Например, овальбумин необратимо коагулирует при 800 МПа, тогда как растворы альбумина не претерпевают изменений даже при 1,9 ГПа. Д. может препятствовать тепловой денатурации белка и даже вызывать ренатурацию белка, денатурированного нагреванием. Большинство ферментов инактивируется под действием Д. Например, активность пепсина снижается с повышением Д. и при 600 МПа исчезает. Однако в ряде случаев Д. стимулирует активность ферментов. Так, активность ксантиндегидрогеназы с ростом Д. возрастает и проходит через максимум: при 500 МПа ее реакционная способность в 7–8 раз выше, а при 600 МПа лишь в 4 раза превышает активность этого фермента при атмосферном Д. Выше 600 МПа наступает полная инактивация ксантиндегидрогеназы. Растворы молекул ДНК устойчивы к Д.: они не претерпевают изменений даже при сжатии до 1,9 ГПа.
положительны и могут исчисляться сотнями см3/моль). Денатурирующее влияние Д. зависит от природы белка, температуры и pH среды. Например, овальбумин необратимо коагулирует при 800 МПа, тогда как растворы альбумина не претерпевают изменений даже при 1,9 ГПа. Д. может препятствовать тепловой денатурации белка и даже вызывать ренатурацию белка, денатурированного нагреванием. Большинство ферментов инактивируется под действием Д. Например, активность пепсина снижается с повышением Д. и при 600 МПа исчезает. Однако в ряде случаев Д. стимулирует активность ферментов. Так, активность ксантиндегидрогеназы с ростом Д. возрастает и проходит через максимум: при 500 МПа ее реакционная способность в 7–8 раз выше, а при 600 МПа лишь в 4 раза превышает активность этого фермента при атмосферном Д. Выше 600 МПа наступает полная инактивация ксантиндегидрогеназы. Растворы молекул ДНК устойчивы к Д.: они не претерпевают изменений даже при сжатии до 1,9 ГПа.
Методы создания высоких Д. Статич. Д. до неск. сотен МПа в жидкостях и газах создают насосами или компрессорами. С их помощью реакционная смесь нагнетается в аппарат высокого Д., в котором компоненты смеси взаимод. при заданных Д. и температуре. В качестве аппаратов высокого Д. широко используют автоклавы (рис. 5)-цилиндрич. сосуды емкостью от десятков см3 до неск. м3, снабженные герметич. затвором. Автоклавы изготавливают, как правило, из высококачественных сталей; внутренняя поверхность аппарата нередко футеруется химически стойкими материалами (фторопласты, эмаль). Автоклавы могут снабжаться мешалками, оси которых выводятся через сальник. Внутри автоклава может размещаться мешалка с ротором электромотора; при этом электромагнитное поле статора, расположенного снаружи, взаимод. с ротором через стенки автоклава, выполненные из немагнитного материала. Д. в автоклаве либо создается компрессором, либо возникает в результате разогрева выделяющимся при реакции теплом или внешнего обогрева. Диапазон Д. и температур, создаваемых в автоклавах, ограничен обычно 100 МПа и 600 К.
Для создания Д., исчисляемых ГПа, служат устройства, использующие разл. конструкционные принципы. Вещество, помещенное в цилиндрич. сосуд, сжимается при вдавливании штоков с помощью пресса (рис. 6а). Гидравлич. пресс и камера высокого Д. могут быть объединены в одну конструкцию-мультипликатор (рис. 6б). Д. в рабочей камере мультипликатора рассчитывается по соотношению: РВ = pH(SH/SB), где SH и SB-площади поршней цилиндров низкого (рн) и высокого (РВ) Д. При использовании высокопрочных сталей для цилиндра и сверхтвердых сплавов для штоков эта конструкция позволяет работать при Д. до 4–5 ГПа. В аппаратуре типа наковален (рис. 6в) вещество размещается между плоскостями двух усеченных конусов (наковален). Для создания высокого Д. наковальни сжимают с помощью пресса. Большая прочность аппаратуры достигается использованием двух конструкционных приемов: заменой напряжений растяжения напряжением сжатия и массивной поддержкой нагруженной центральной части наковален со стороны прилегающих ненагруженных частей. Наковальни изготавливают обычно из твердых сплавов. Достоинства такой аппаратуры-простота конструкции и возможность достижения Д. в десятки ГПа, недостаток-малый объем рабочего пространства.
Для физ.-хим. исследований при высоких Д. применяют установки с прозрачными наковальнями из алмазов, обеспечивающие Д. до 200 ГПа и температуры до 3000 К. Такие установки компактны (располагаются на столике микроскопа). Нагрев образца осуществляют лазерным лучом. Для измерения Д. внутрь аппарата помещают кристалл рубина и следят за его спектром люминесценции, линия которого смещается с увеличением Д. линейно до 30 ГПа. Помимо визуального наблюдения, эти аппараты позволяют проводить исследования методами УФ, ИК, рентгеновской и гамма-резонансной спектроскопии. Для достижения Д. в 100–200 ГПа при температурах до 2500 К используют установки, в которых совмещаются конструкционные приемы аппаратов типа цилиндр-поршень и типа наковален (рис. 6г). Д. в образце создается при вдавливании конич. пуансонов с помощью пресса. Достоинство аппаратов-сравнительно большой объем рабочего пространства, недостаток-сложность в изготовлении.
Рис. 5. Схема типового автоклава: 1 — корпус; 2 — крышка; 3 — манометр; 4 — карман для термопары; 5 — вентиль.
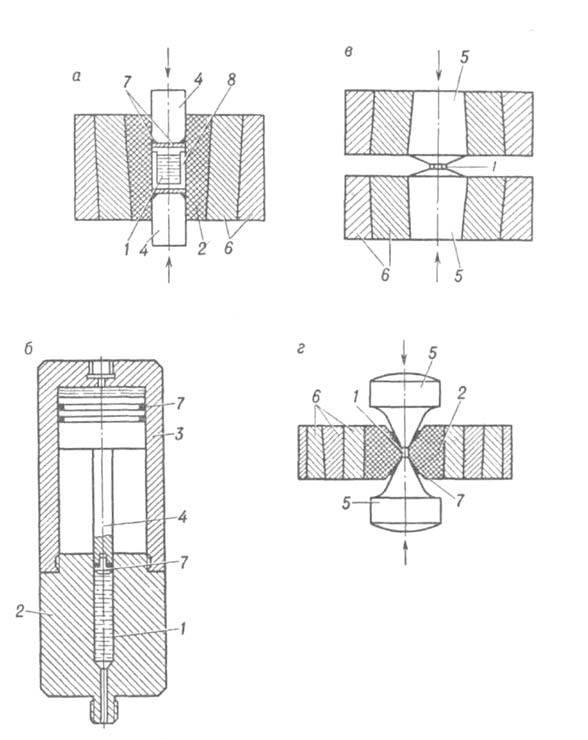
Рис. 6. Схема установок, применяемых для физ.-хим. исследований при высоких давлениях: а-цилиндр со штоками; 6 — мультипликатор; в-аппаратура типа наковален; г-устройство с конич. пуансонами, 1 — исследуемое вещество; 2 — цилиндр высокого давления; 3 — цилиндр низкого давления; 4 — штоки; 5 — пуансоны; 6 — поддерживающие кольца; 7 — уплотнения; 8 — ампула с веществом.
Для экспериментов в условиях высоких Д. и деформаций сдвига используют аппаратуру типа наковален. Между наковальнями располагают слой твердой реакционной смеси, в котором создается Д. при сжатии наковален с помощью пресса. Заданная деформация сдвига производится поворотом одной из наковален на определенный угол. Время поворота наковален (а след., и хим. превращения) обычно исчисляется с или долями с.
Статич. высокие Д. широко используют в хим. промышленности. Среди особо важных процессов — производство синтетич. алмазов (5–6 ГПа), синтез боразона (6–8 ГПа), полимеризация этилена (120–320 МПа), гидротермальный синтез минералов (до 300 МПа), гидрогенизация угля (до 70 МПа), синтез метанола (30 МПа) и аммиака (30 МПа), гидрокрекинг (5–20 МПа) и др. При лаб. исследованиях жидкофазных хим. процессов высокие Д. (500–1500 МПа) используют гл. обр. для сокращения продолжительности хим. превращений. Особенно это важно, если скорость реакции при атмосферном Д. низка, а повышать ее путем нагрева реакционной смеси нежелательно из-за возможности возникновения побочных реакций или нестойкости реагентов (продуктов) реакции. При высоких Д. проводят распространенные в лаб. практике синтезы, если необходимо увеличить выход целевого продукта.
Лит.: Гоникберг М. Г., Химическое равновесие и скорость реакций при высоких давлениях, 3 изд., М., 1969; Циклис Д.С., Техника физико-химических исследований при высоких и сверхвысоких давлениях, 4 изд., М., 1976; Проблемы эксперимента в твердофазной и гидротермальной аппаратуре высокого давления, под ред. И.П.Иванова и Ю.А. Литвина, М., 1982; Жаров А.А., "Успехи химии", 1984, т. 53, в. 2, с. 236–50; Современная техника и методы экспериментальной минералогии, под .ред. В.А.Жарикова. И.П.Иванова и Ю.А. Литвина, М., 1985; Isaacs N.S., Liquid phase high pressure chemistry, N. Y.-Brisban-Toronto, 1981; H ereman s K., "Ann.Rev.Biopbys", 198Z X"0 11, p. 1–21; Matsumoto K, Sera A., Uchida Т., "Syptesis", 1985, № 1, p. 1–26; № 11, p. 99.
А. А. Жаров
Значения в других словарях
- ДАВЛЕНИЕ — Физ. величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с к-рыми одно тело действует на поверхность другого (напр., фундамент здания на грунт, жидкость на стенки сосуда, газ в цилиндре двигателя на поршень). Физический энциклопедический словарь
- давление — -я, ср. 1. Действие по глаг. давить (в 1 и 2 знач.). Под давлением чьей-то ноги галька раздавалась в стороны. Арсеньев, По Уссурийской тайге. Калломейцев поболтал в воздухе обнаженной левой рукой, освобожденной от давления перчатки. Тургенев, Новь. Малый академический словарь
- давление — Давл/е́ни/е [й/э]. Морфемно-орфографический словарь
- Давление — Физическая величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с которыми одно тело действует на поверхность другого (например, фундамент здания на грунт, жидкость на стенки сосуда... Большая советская энциклопедия
- давление — орф. давление, -я Орфографический словарь Лопатина
- давление — Под давлением (книжн.) — под принудительным влиянием, вследствие воздействия. ► Под давлением обстоятельств. Фразеологический словарь Волковой
- давление — ДАВЛЕНИЕ - атмосферное Д. Давление окружающего земной шар слоя воздуха на его поверхность, составляющее на уровне моря 1,033 кг на 1 см , что уравновешивает столб ртути высотой 760 мм. С высотой убывает. Словарь спортивных терминов
- давление — • большое ~ • высокое ~ • колоссальное ~ • максимальное ~ • огромное ~ • сильное ~ Словарь русской идиоматики
- давление — Галстук Словарь воровского жаргона
- давление — см. >> бремя, влияние, иго, насилие см. также -> оказывать давление, производить давление Словарь синонимов Абрамова
- давление — давление , -я Орфографический словарь. Одно Н или два?
- давление — сущ., с., употр. сравн. часто (нет) чего? давления, чему? давлению, (вижу) что? давление, чем? давлением, о чём? о давлении; мн. что? давления, (нет) чего? давлений, чему? давлениям, (вижу) что? давления, чем? давлениями, о чём? о давлениях; см. глаг. Толковый словарь Дмитриева
- ДАВЛЕНИЕ — ДАВЛЕНИЕ, в физике — сила, действующая на поверхность тела, деленная на площадь этой поверхности. В системе измерения СИ измеряется в ПАСКАЛЯХ (обозначается Па); 1 Па равен 1 N.м-2 (ньютон на м2). Научно-технический словарь
- давление — ДАВЛЕНИЕ -я; ср. 1. к Давить (1-2, 5, 8 зн.). Освободиться от давления шлема. Стереться под легким давлением ногтя. Заняться давлением соков. 2. Сила, действующая на какую-л. поверхность; степень упругости газов и жидкостей. Д. пара. Д. воды. Световое... Толковый словарь Кузнецова
- давление — ДАВЛЕНИЕ, я, ср. 1. см. давить. 2. Сила действия одного тела на поверхность другого (спец.). Д. жидкости на стенки сосуда. Д. воды. Атмосферное д. Кровяное д. (давление крови в сосудах). 3. То же, что кровяное давление (разг.). Повышенное, пониженное... Толковый словарь Ожегова
- давление — См. давить Толковый словарь Даля
- давление — ДАВЛ’ЕНИЕ, давления, ср. (·книж. ). 1. Действие по гл. давить в 1 и 7 ·знач. 2. Степень упругости (газов и жидкостей; физ. тех.). Давление воды. Паровой котел высокого давления. Атмосферное давление. 3. перен. Толковый словарь Ушакова
- давление — давление I ср. 1. Процесс действия по гл. давить I 1., 3., 4., 6. || Результат такого действия. 2. Сила, действующая на какую-либо поверхность в расчёте на единицу площади поверхности. 3. перен. Толковый словарь Ефремовой
- ДАВЛЕНИЕ — ДАВЛЕНИЕ — физическая величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил F, с которыми одно тело действует на поверхность S другого (напр., фундамент здания на грунт, жидкость на стенки сосуда и т. п.). Большой энциклопедический словарь
- Давление — В механике и математической физике под давлением на какое-либо тело подразумевается совокупность сил, сплошным образом приложенных к поверхности тела и направленных по нормалям ее внутрь тела; таковы, напр. Энциклопедический словарь Брокгауза и Ефрона
