гидриды
ГИДРИДЫ
соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, Г., комплексные (см., напр., алюмогидриды, борогидриды металлов) и Г. интерметаллич. соединений. Для большинства переходных металлов известны также комплексные соед., содержащие атом Н наряду с др. лигандами в координац. сфере металла-комплексообразователя.
Простые гидриды. Известны для всех элементов, кроме благородных газов, платиновых металлов (исключение -Pd), Ag, Au, Cd, Hg, In, Tl. В зависимости от природы связи элемента (Э) с водородом подразделяются на ковалентные, ионные (солеобразные) и металлоподобные (металлические), однако эта классификация условна, т. к. между разл. типами простых Г. резких границ нет.
К ковалентным относят Г. неметаллов, Al, Be, Sn, Sb. Гидриды SiH4, GeH4, SnH4, PH3, AsH3, SbH3, H2S, H2Se, H2Te (см. табл. 1) и низшие бороводороды-газы. Ковалентные Г. обладают высокой реакц. способностью. Эффективный положит. заряд атома Э в молекуле возрастает в пределах одной группы периодич. системы с увеличением его порядкового номера. Элементы Si и Ge образуют высшие Г. общей формулы ЭnH2n + 2 (п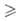 2), стабильность которых быстро уменьшается с увеличением числа атомов Э. Гидриды элементов подгруппы S хорошо раств. в воде (растворы имеют кислую реакцию), подгруппы Р-незначительно. Г. элементов подгруппы Si взаимод. с водой с образованием ЭO2 и H2. Все эти Г. раств. в неполярных или малополярных органических растворителях. Ковалентные Г. — сильные восстановители. Легко вступают в обменные реакции, напр. с галогенидами металлов. При 100–300 °C (H2S ок. 400 °C) разлагаются практически необратимо до Э и H2.
2), стабильность которых быстро уменьшается с увеличением числа атомов Э. Гидриды элементов подгруппы S хорошо раств. в воде (растворы имеют кислую реакцию), подгруппы Р-незначительно. Г. элементов подгруппы Si взаимод. с водой с образованием ЭO2 и H2. Все эти Г. раств. в неполярных или малополярных органических растворителях. Ковалентные Г. — сильные восстановители. Легко вступают в обменные реакции, напр. с галогенидами металлов. При 100–300 °C (H2S ок. 400 °C) разлагаются практически необратимо до Э и H2.
Табл. 1 — СВОЙСТВА ПРОСТЫХ КОВАЛЕНТНЫХ И ИОННЫХ ГИДРИДОВ
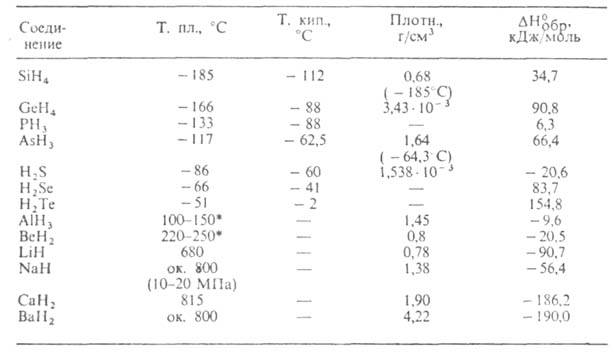
* Температура разложения.
Г. подгруппы фосфора получают реакцией ЭCl3 с Li[AlH4] в эфире при 25 °C; SiH4 и GeH4-взаимод. Mg2Э с водой или с В2H6 в жидком NH3; H2S, H2Se и H2Те-кислотным гидролизом сульфидов, селенидов или теллуридов металлов (H2S-также взаимод. Н, и S). Все упомянутые Г., особенно AsH3 и PH3, высокотоксичны. Гидриды Ge, Si, As используют для получения полупроводниковых материалов.
• см. также мышьяка гидрид, сероводород, силаны, фосфины
Гидриды BeH2 и А1H3, существующие в полимерном состоянии, а также крайне нестойкий термически Ga2H6 по природе хим. связи Э—Н близки к бороводородам: для них характерен дефицит электронов, в связи с чем образование молекул или кристаллов происходит с участием двухэлектронных трехцентровых мостиковых (Э—Н—Э) и многоцентровых связей. Для этих Г. характерны очень высокие энтальпии сгорания. Они взаимод. с водой, выделяя H2. С донорами электронов, напр. с NR3, PR3, образуют аддукты, с В2H6 в среде апротонных орг. растворителей — соотв. Al[BH4]3 и Ве[BH4]2. Получают гидриды А1 и Be по реакциям:
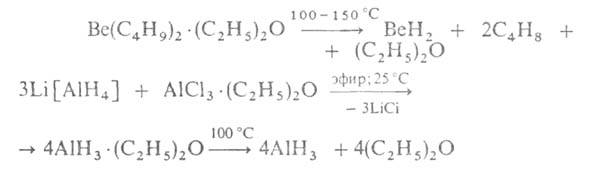
К ионным относят Г. щелочных и щел.-зем. металлов (кроме Mg). Эти соед. — структурные аналоги соответствующих галогенидов. Представляют собой кристаллы, которые в расплавл. состоянии проводят электрич. ток, причем H2 выделяется на аноде. Не раств. в органических растворителях, хорошо раств. в расплавах галогенидов щелочных металлов. Обладают высокой хим. активностью, бурно реагируют с O2 и влагой воздуха. Взаимод. с водой (напр., МН + H2O → МОН + H2) сопровождается выделением тепла. В эфире, диглиме, ТГФ легко (особенно LiH и NaH) реагируют с галогенидами или гидридами В и А1, образуя соотв. борогидриды М[BH4]n и алюмогидриды М[А1H4]n. При 700–800 °C восстанавливают оксиды до металлов. С CO2 дают соли муравьиной кислоты. Взаимод. с N2, напр. 3CaH2 + N2 → Ca3N2 + ЗH2.
Получают ионные Г. обычно взаимод. H2 с расплавом соответствующего металла под давлением. Их используют в качестве сильных восстановителей (напр., для получения металлов из их оксидов или галогенидов, удаления окалины с поверхностей изделий из стали и тугоплавких металлов). Многие Г. — источники H2, перспективное ракетное топливо. Дейтериды и тритиегидриды — возможное горючее для ядерных реакторов.
• см. также лития гидрид
Гидрид Mg по свойствам и природе хим. связи занимает промежут. положение между ковалентными и ионными Г.; кристаллы с решеткой типа TiO2; при высоких давлениях ( ~ 7 МПа) претерпевает полиморфные превращения. С водой и водными растворами кислот и щелочей MgH2 взаимод. с выделением H2, однако менее энергично, чем Г. щелочных и др. щел.-зем. металлов. М. б. получен взаимод. Mg с H2 при 200–250 °C и давлении 10 МПа (скорость реакции мала) либо обменной реакцией MgHal2 с МН или М [А1H4], где М—Li, Na, в среде орг. растворителя. Легко образуется при гидрировании сплавов Mg, содержащих небольшие добавки РЗЭ и переходных металлов, при 150–180 °C и 1–5 МПа, причем реакция обратима. В связи с этим такие сплавы-перспективные хим. аккумуляторы H2 для нужд малой энергетики, металлургии и хим. технологии.
К металлоподобным относят Г. переходных металлов и РЗЭ. Формально такие соед. могут рассматриваться как фазы внедрения водорода в металл. Их образованию всегда предшествует адсорбция H2 на поверхности металла.
Адсорбированная молекула диссоциирует на атомы Н, в результате диффузии которых в кристаллич. решетку происходит образование т.н. раствора водорода в металле; процесс не сопровождается перестройкой кристаллич. решетки. При достижении определенной концентрации H2 в
раствора водорода в металле; процесс не сопровождается перестройкой кристаллич. решетки. При достижении определенной концентрации H2 в растворе образуется собственно Г. металла
растворе образуется собственно Г. металла , как правило, стехиометрич. состава (МH3 для металлов III гр., МH2 для IV гр. и ванадия). Взаимод. H2 с указанными металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки. Для описания природы хим. связи водорода с металлич. матрицей используют представление о типе связи, промежуточном между ионной и металлической; электроны водорода в большей или меньшей степени участвуют в формировании зоны проводимости Г. По-видимому, вклад ионной составляющей связи М+ —H− Наиб. велик для EuH2, YbH2 и тригидридов лантаноидов и минимален для PdH0,6, а также для гидридов Mn, Fe, Co, Ni, существующих при высоких давлениях H2 и содержащих менее одного атома Н на атом металла.
, как правило, стехиометрич. состава (МH3 для металлов III гр., МH2 для IV гр. и ванадия). Взаимод. H2 с указанными металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки. Для описания природы хим. связи водорода с металлич. матрицей используют представление о типе связи, промежуточном между ионной и металлической; электроны водорода в большей или меньшей степени участвуют в формировании зоны проводимости Г. По-видимому, вклад ионной составляющей связи М+ —H− Наиб. велик для EuH2, YbH2 и тригидридов лантаноидов и минимален для PdH0,6, а также для гидридов Mn, Fe, Co, Ni, существующих при высоких давлениях H2 и содержащих менее одного атома Н на атом металла.
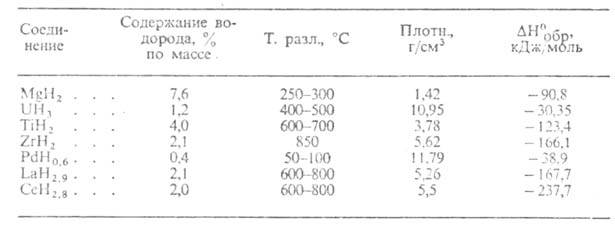
Металлоподобные Г. (см. табл. 2)-светло- и темно-серые кристаллы с металлич. блеском, устойчивые на воздухе при комнатной температуре. С O2, водой и водяным паром реагируют медленно. М.б. получены взаимод. металла с H2 при обычной температуре или при нагр.; напр., TiH2 и LaH3 синтезируют при 150–200 °C. Получение Г. стехиометрич. состава в большинстве случаев сопряжено со значит. трудностями из-за высокой чувствительности гидрироваиия к наличию примесей в металле и особенно O2 и водяных паров в H2. Металлоподобные Г. ограниченно применяют в качестве источников H2 высокой чистоты (используемых, напр., в топливных элементах) и для поглощения H2 из газовых смесей. Гидриды Pd-катализаторы гидрирования, изомеризации, орто- и парапревращения H2.
Табл. 2 — СВОЙСТВА МЕТАЛЛОПОДОБНЫХ ГИДРИДОВ
Гидриды интерметаллических соединений. Содержат обычно атомы РЗЭ, Mg, Ca, Ti, Al, Fe, Co, Ni, Cu. Легко образуются при взаимодействии интерметаллидов даже с техн. H2 (содержащим до 1–2% примесей O2 и водяного пара) при 25–200 °C и давлениях H2 0,1–1 МПа; скорость поглощения H2 очень велика. Реакции характеризуются малыми тепловыми эффектами (20–30 кДж на 1 моль H2, для индивидуальных металлов-100–120 кДж) и не приводят к значит. изменениям в структуре исходной металлич. матрицы; в большинстве случаев происходит лишь увеличение ее объема на 10–30%. Для Г. этого типа характерна высокая подвижность водорода и большая хим. активность (о свойствах см. также табл. 3).
При 200–500 °C и давлениях H2 104–105 Па происходит гидрогенолиз интерметаллидов: мнх + м'ну <- мм'n + н2 → мнх + пМ'
Данная реакция характерна для соед., образованных РЗЭ и Mg, а также РЗЭ и Fe, Ni или Со. Так, гидрид РЗЭ, образующийся при гидрогенолизе интерметаллида, содержащего Mg, катализирует как гидрирование Mg, так и дегидрирование MgH2 при 150–180 °C: МH2 + nMg + (n + 0,5) H2 МH3 + nMgH2
МH3 + nMgH2
Благодаря высокому содержанию H2, возможности значит. смещения равновесия в ту или др. сторону посредством небольших изменений температуры и давления H2, способности поглощать H2 при низких температурах и устойчивости к действию O2 и влаги воздуха, Г. интерметаллич. соединений м. б. использованы как хим. аккумуляторы слабосвязанного водорода. Перспективно их применение как источников топлива для автономных энергосистем, напр. автомобильного транспорта (см. водородная энергетика), а также для получения высокодисперсных металлич. порошков и катализаторов гетерог. гидрирования.
Табл. 3 — СВОЙСТВА ГИДРИДОВ ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ

Лит.: Гидриды металлов, пер. с англ., М., 1973; Девятых ГГ., Зорин А. Д., Летучие неорганические гидриды особой чистоты, М., 1974; Антонова А. М., Морозова Р. А., Препаративная химия гидридов. К., 1976; Водород в металлах, пер. с англ., т. 2, М., 1981.
К. Н. Семененко
Значения в других словарях
- Гидриды — Соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные. К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Большая советская энциклопедия
- гидриды — орф. гидриды, -ов, ед. -ид, -а Орфографический словарь Лопатина
- гидриды — [гр. вода + вид] – хим. водородистые металлы; соединения водорода с металлами (натрием, калием, кальцием и др.) Большой словарь иностранных слов
- гидриды — гидриды мн. Химические соединения водорода с каким-либо другим элементом. Толковый словарь Ефремовой
- ГИДРИДЫ — ГИДРИДЫ — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды — промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов. Большой энциклопедический словарь
