галлия оксиды
ГАЛЛИЯ ОКСИДЫ
Сесквиоксид Ga2O3-белые кристаллы. Наиб. устойчива р-модификация с моноклинной решеткой типа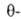 Al2O3 (a = 1,223нм, b = 0,304 нм, с = = 0,508 нм,
Al2O3 (a = 1,223нм, b = 0,304 нм, с = = 0,508 нм, 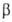 103,7°, z = 4, пространственная группа С2/m); т. пл. 1725 °C; плотн. 5,88 г/см3; C0 92,18 Дж/(моль∙К);
103,7°, z = 4, пространственная группа С2/m); т. пл. 1725 °C; плотн. 5,88 г/см3; C0 92,18 Дж/(моль∙К); 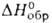 - 1090 кДж/моль,
- 1090 кДж/моль, 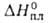 519 кДж/моль,
519 кДж/моль, 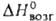 574 кДж/моль; S0298 85,1 Дж/(моль∙К);
574 кДж/моль; S0298 85,1 Дж/(моль∙К); 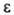 10,2; выше 1200 °C частично диссоциирует на Ga2O и O2; уравнение температурной зависимости давления пара: 1§р(гПа) = 13,66 —
10,2; выше 1200 °C частично диссоциирует на Ga2O и O2; уравнение температурной зависимости давления пара: 1§р(гПа) = 13,66 —
26010/Т (1530–1840 К). Полупроводник n-типа; ширина запрещенной зоны 4,6–4,7 эВ (27 °C). Не раств. в воде и органических растворителях. С минеральными кислотами образует соли Ga, с растворами щелочей — галлаты. После прокаливания выше 600 °C взаимод. только с расплавленными щелочами и гидросульфатами щелочных металлов. При спекании с оксидами или карбонатами др. металлов образует галлаты. Получают Ga2O3 прокаливанием Ga(NO3)3 или Ga(OH)3 при 200–250 °C, затем в течение 12 ч при 600 °C. Применяют его для получения галлиево-гадолиниевого граната и др. соединений Ga. Теми оксид Ga2O-темно-коричневое, серое или черное вещество; т. пл. ок. 650 °C, т. кип. ок. 725 °C; плотн. 4,77 г/см3 (20 °C); 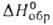 твердого вещества −356 кДж/моль; для газа C0p 48,2 Дж/(моль∙К),
твердого вещества −356 кДж/моль; для газа C0p 48,2 Дж/(моль∙К), 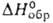 −85,9 кДж/моль; S0298 284 Дж/(моль∙К). Устойчив в сухом воздухе при 20 С, в отсутствие O2 и паров H2O — до 600 °C. В интервале 700–1000 °C легко диспропорционирует на Ga и Ga2O3, в парах выше 1000 °C не днспропорционирует. Уравнение температурной зависимости давления пара над смесью Ga2O3 с Ga: 1gр(гПа) = 11,90- 13490/Т (1000–1100 К). Ga2O- сильный восстановитель, легко окисляется при нагр.; медленно взаимод. с разб. кислотами, энергично — с концентрированными. М. б. получен нагреванием Ga в атмосфере CO2 или паров H2O (в присут. H2), а также восстановлением Ga2O3 галлием с послед. сублимацией в вакууме. Ga2O — промежут. соед. при получении эпитаксиальных пленок GaAs и GaP с помощью хим. транспортных реакций.
−85,9 кДж/моль; S0298 284 Дж/(моль∙К). Устойчив в сухом воздухе при 20 С, в отсутствие O2 и паров H2O — до 600 °C. В интервале 700–1000 °C легко диспропорционирует на Ga и Ga2O3, в парах выше 1000 °C не днспропорционирует. Уравнение температурной зависимости давления пара над смесью Ga2O3 с Ga: 1gр(гПа) = 11,90- 13490/Т (1000–1100 К). Ga2O- сильный восстановитель, легко окисляется при нагр.; медленно взаимод. с разб. кислотами, энергично — с концентрированными. М. б. получен нагреванием Ga в атмосфере CO2 или паров H2O (в присут. H2), а также восстановлением Ga2O3 галлием с послед. сублимацией в вакууме. Ga2O — промежут. соед. при получении эпитаксиальных пленок GaAs и GaP с помощью хим. транспортных реакций.
В парах при высоких температурах наблюдался оксид GaO.
Лит. см. при ст. галлий.
П. И. Федоров
