галлий
ГАЛЛИЙ (от Gallia-Галлия, лат. назв. Франции; лат. Gallium) Ga
хим. элемент III гр. периодической системы, ат. н. 31, ат. м. 69,72. Прир. Г. состоит из изотопов 69Ga (61,2%) и 71Ga (38,8%), поперечное сечение захвата тепловых нейтронов соотв. 2,1∙10−28 и 5,1∙10−28 м2. Конфигурация внеш. электронной оболочки 4s24p1; степень окисления + 1 и +3; энергия ионизации Ga° → Ga+ → Ga2+ → Ga3+ соотв. равна 5,998, 20,5144 и 30,66 эВ; электроотрицательность по Полингу 1,6; атомный радиус 0,139 нм; ионный радиус для Ga3 (в скобках указано координац. число) 0,061 нм (4), 0,069 нм (5) и 0,076 нм (6).
Содержание Г. в земной коре 1,8∙10−3 % по массе, в воде морей и океанов 3∙10−5 мг/л. В природе встречается в виде чрезвычайно редких минералов — зенгеита Ga(OH)3, галлита CuGaS2 и др. Является спутником Al, Zn, Ge, Fe; содержится в сфалеритах (до 0,018% по массе), нефелине (среднее содержание 0,004%), натролите (до 0,1%), бокситах (среднее содержание 0,005%), германите (0,7–1,8%), алуните (0,001–0,06%), в углях и железных рудах некоторых месторождений и др. Потенциальные мировые запасы Г. в бокситах св. 1 млн. т, в цинковых рудах ок. 10000 т.
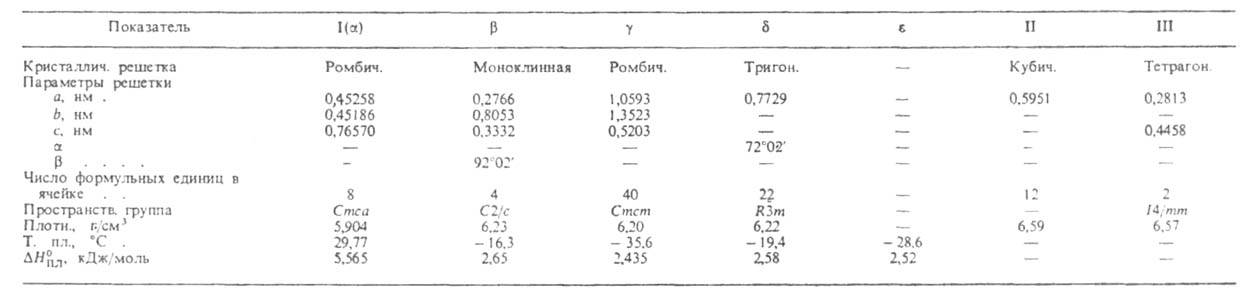
Свойства. Г. — светло-серый металл с синеватым оттенком. Расплав Г. может находиться в жидком состоянии при температурах ниже температуры плавления в течение неск. месяцев. Кристаллич. решетка устойчивой модификации I (или α; см. табл. и рис.) образована двухатомными молекулами с длиной связи 0,244 нм, которые сохраняются и в жидком металле; в парах Г. одноатомен. Из переохлажденного диспергиров. металла кристаллизуются неустойчивые модификации-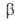 ,
, 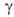 ,
, 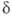 и
и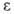 ; при давлениях выше 1,14 и 3,0 ГПа обнаружены модификации соотв. II и III; существуют также еще две метастабильные фазы Г. Конденсацией паров при 4,2 К получен аморфный галлий. Т. кип. 2205 °C; плотность жидкого 6,0948 г/см3; C0p 26,07 Дж/(моль∙К);
; при давлениях выше 1,14 и 3,0 ГПа обнаружены модификации соотв. II и III; существуют также еще две метастабильные фазы Г. Конденсацией паров при 4,2 К получен аморфный галлий. Т. кип. 2205 °C; плотность жидкого 6,0948 г/см3; C0p 26,07 Дж/(моль∙К); 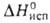 271 кДж/моль (О К); S0298 40,81 Дж/(моль∙К). Уравнения температурных зависимостей давления пара над жидким веществом, плотности и поверхностного натяжения:
271 кДж/моль (О К); S0298 40,81 Дж/(моль∙К). Уравнения температурных зависимостей давления пара над жидким веществом, плотности и поверхностного натяжения:

Температурный коэф. объемного расширения 5,5∙10−5 К−1, линейного расширения поликристаллич. Г. 2,0∙10−5 К−1, жидкого 10,9*Ю−5 К−1; теплопроводность 4,82∙10−3 Вт/(м-К), жидкого 2,85∙10−3 Вт/(м∙К) при 77 °C.
При комнатной температуре Г. пластичен и м. б. прокатан в тонкие листы. Твердость по Бринеллю 25 МПа; 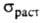 20–38 МПа; относит. удлинение 2–40%;
20–38 МПа; относит. удлинение 2–40%; 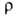 0,449 мкОм∙м (28 °C), жидкого 0,258 мкОм∙м (30 °C); температурный коэф.
0,449 мкОм∙м (28 °C), жидкого 0,258 мкОм∙м (30 °C); температурный коэф.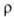 3,96∙10−3 К−1, жидкого 8,15∙10−4 К−1 (30–100 °C). Стандартный электродный потенциал (Ga/Ga3+) в растворе соли Г. −0,56 В, в щелочном растворе —1,326 В. Твердый Г. диамагнитен, жидкий слегка парамагнитен (магн. восприимчивость 210−9 и мало зависит от температуры). При 1,09 К Ga I переходит в сверхпроводящее состояние. В жидком Г. раств. In, Sn, Zn, Al, Au, Ag, Cu. Сплавы на основе Г., жидкие при комнатной температуре, наз. галламами.
3,96∙10−3 К−1, жидкого 8,15∙10−4 К−1 (30–100 °C). Стандартный электродный потенциал (Ga/Ga3+) в растворе соли Г. −0,56 В, в щелочном растворе —1,326 В. Твердый Г. диамагнитен, жидкий слегка парамагнитен (магн. восприимчивость 210−9 и мало зависит от температуры). При 1,09 К Ga I переходит в сверхпроводящее состояние. В жидком Г. раств. In, Sn, Zn, Al, Au, Ag, Cu. Сплавы на основе Г., жидкие при комнатной температуре, наз. галламами.
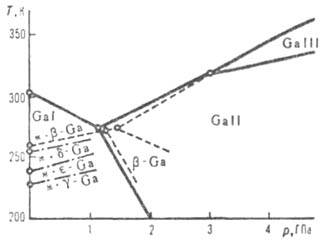
Диаграмма состояния галлия (ж-жидкость).
СВОЙСТВА ПОЛИМОРФНЫХ МОДИФИКАЦИЙ ГАЛЛИЯ
По химическим свойствам Г. весьма сходен с А1. На воздухе на повети металла образуется пленка оксида, предохраняющая Г. от дальнейшего окисления (см. галлия оксиды). При нагр. Г. с водой под давлением образуется GaOOH. С минеральными кислотами Г. медленно реагирует уже на холоду, образуя соли; при взаимодействии с растворами щелочей, а также с Na2CO3 и K2CO3 образуются гидроксогаллаты, содержащие ионы Ga(OH)4− и, возможно, Ga(OH)63− и Ga(OH)2−. Г. реагирует с Cl2 и F2 при комнатной температуре, с Br2 — уже при −35 °C (ок. 20 °C — с воспламенением), с I2 — при нагревании. С H2, С, N2, Si и В не взаимодействует. При высоких температурах Г. разрушает разл. материалы сильнее, чем расплав любого др. металла. Графит и W устойчивы к действию Г. до 800 °C, алунд и ВеО до 1000 °C, Та до 450 °C, Mo и Nb до 400 °C, Be до 600 °C, Re до 700 °C. С металлами (кроме металлов подгрупп Пб, IIIa, IVa и Bi) Г. образует галлиды, из которых особый интерес представляют Nb3Ga и V3Ga. Последний образуется при 1300 °C; температура перехода в сверхпроводящее состояние для V3Ga 16,8 К.
С мышьяком, фосфором и сурьмой Г. образует соотв. галлия арсенид, галлия фосфид и галлия антимонид, с S, Se и Те при 600–1100 °C-халькогениды Ga,X3, Ga2X2, Ga2X, Ga4X5, Ga2X5. Сесквисульфид Ga2S3-белые (плотн. 3,650 г/см3), светло-желтые (3,74 г/см3) или оранжевые кристаллы; т. пл. 1125 °C. Сульфид Ga2S2-желтые кристаллы; т. пл. 1015 °C; плотн. 3,75 г/см3. Селенид Ga,Se2-темно-красные кристаллы; т. пл. 960 °C; плотн. 5,03 г/см3; используется как полупроводник. Сесквителлурид Ga2Te3-черные кристаллы; т. пл. 810 °C; плотн. 5,582 г/см3.
При взаимодействии Ga или его соединений с NH3 при 1050–1200 °C получают нитрид GaN-кристаллы, решетка типа вюрцита (а = 0,3186нм, b = 0,5178нм); т. пл. ~ 1700 °C (под давлением N2 более 20 МПа); плотн. 6,1 г/см3; 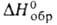 −109,8 кДж/моль; ширина запрещенной зоны 3,39 эВ (27 °C; не взаимод. с водой, растворами минеральных кислот и царской водкой, медленно реагирует с растворами щелочей, окисляется на воздухе при 800 °C. GaN-материал для светодиодов и прозрачных диэлектрич. покрытий; перспективен как материал инжекционных лазеров.
−109,8 кДж/моль; ширина запрещенной зоны 3,39 эВ (27 °C; не взаимод. с водой, растворами минеральных кислот и царской водкой, медленно реагирует с растворами щелочей, окисляется на воздухе при 800 °C. GaN-материал для светодиодов и прозрачных диэлектрич. покрытий; перспективен как материал инжекционных лазеров.
Из солей Г. Наиб. значение имеет трихлорид GaCl3 (см. галлия галогениды). Сульфат кристаллизуется из сернокислых растворов в виде Ga2(SO4)3*20H2O; раств. в воде (170 г в 100 г); обезвоживается при 40–360 °C; выше 500 °C разлагается; с сульфатами щелочных металлов (кроме Li и Na) и аммония образует квасцы. Нитрат Ga(NO3)3 кристаллизуется в виде нона- или гептагидрата; хорошо раств. в воде (295 г нонагидрата в 100 г), спирте, не раств. в эфире; гигроскопичен, расплывается на воздухе. Ортофосфат GaPO4-кристаллы; т. пл. 1670 °C; плотн. 3,26 г/см3; не раств. в воде; получают действием гидрофосфатов щелочных металлов или H3PO4 на растворы солей Г.
Из водных растворов солей Г. (при pH 3,0–4,1) и галлатов (при pH 9,7–6,4) осаждается гидроксид Ga(OH)3*xH2O. Кислотные свойства Ga(OH)3 (или ортогаллиевой кислоты H3GaO3) выражены сильнее основных; он является более сильной кислотой, чем А1(OH)3, поэтому растворы солей кислот Г. — галлатов устойчивее растворов алюминатов. При нагр. гидроксида до ~ 400 °C образуется GaOOH (или метагаллиевая кислота HGaO2), который выше 550 °C переходит в Ga2O3. Из галлатов наиб. распространены метагаллаты (моногаллаты), содержащие одно- и двухзарядные катионы. Менее распространены ортогаллаты; они образуются со щелочными и щел.-зем. металлами, а также с РЗЭ. Известны нестехиометрич. галлаты щелочных металлов, напр. Na2O*5,3Ga2O3 и Na2O*(5,3 — 7,0)Ga2O3, которые находят применение как твердые электролиты. РЗЭ (начиная с Рг) образуют галлаты типа M3Ga5O12 и M4Ga2O9.
Получение. Осн. источник Г. — алюминатные растворы, получаемые при переработке глинозема и содержащие до 250 мг/л Г. После отделения осн. массы А1 галлиевый концентрат осаждается, напр. карбонизацией (пропусканием CO2), затем его обрабатывают водой в автоклаве или Ca(OH)2, после чего большая часть Г. переходит в раствор; карбонизацией полученных растворов осаждают вторичный концентрат Г. (ок. 1% Ga2O3). Его растворяют в щелочи, обрабатывают Ca(OH)2 и электролизом этого раствора (1,5–2 г/л Ga2O3 и ~ 60 г/л Al2O3) выделяют металлич. Г.
При переработке бокситов по способу Байера Г. концентрируется в маточных растворах (остающихся после отделения осн. массы А1), из которых его выделяют электролизом на ртутном катоде. Образовавшуюся при этом натриево-галлиевую амальгаму (до 1% Г.) разлагают водой или раствором щелочи и из полученного раствора Г. выделяют электролитически. Вместо электролиза на ртутном катоде можно выделять Г. цементацией (вытеснением ионов одного металла из раствора др. металлом) его на амальгаме Na. Разработан способ выделения Г. из алюминатных растворов путем цементации его на галламе А1 при 80 °C. Для выделения Г. галламу разлагают водой. Перспективен метод экстракции Г. из алюминатных растворов фенолами. Источниками для получения Г. могут служить также продукты переработки железных, титановых, германиевых и др. руд.
Рафинирование Г. обычно включает промывку металла водой и кислотами, фильтрование, вакуумную обработку при 800–1100 °C и давл. 1∙10−3гПа, очистку электролизом в щелочном электролите (15–20% NaOH). Используют также частичное окисление металла воздухом или O2 с послед. отделением образующегося Ga2O3 фильтрованием, а также обработку аммиаком при 800 °C. Для получения Г. высокой чистоты применяются методы зонной плавки, направленной кристаллизации или вытягивания слитка из расплава. Используется также метод очистки через галлийорг. соед., в частности через Ga(C2H5)3. Перспективен метод получения Г. высокой чистоты через GaCl3, который м. б. очищен перегонкой, ректификацией, зонной плавкой или противоточной кристаллизацией в колоннах; Г. может быть получен из него электролизом водного раствора или восстановлением H2 в парах при 600–700 °C
Определение. Качественно Г. обнаруживают дуговым или искровым спектральным методом (характеристич. линии 417,206; 403,298; 294,364; 287,424 нм), а также по флуоресценции растворов соед. Г. и 8-гидроксихинолина в CHCl3 или родамина В в C6H6. При количеств. определении Г. отделяют от др. элементов экстракцией из солянокислых растворов эфиром, бутилацетатом и др. Определяют Г. преим. титрованием раствором комплексона III либо фотометрически (флуорометрически) с использованием родамина В, 8-гидроксихинолина, сульфонафтолазорезорцина, галлиона или других орг. реагентов.
Применение. Ок. 97% производимого Г. используется для получения соед., обладающих полупроводниковыми свойствами (напр., GaAs). Сам Г. применяется в радиоэлектронике для "холодной пайки" керамич. и металлич. деталей, для легирования Ge и Si, получения оптич. зеркал спец. назначения. Г. может заменять ртуть в выпрямителях тока. Добавка Г. в качестве легирующей присадки к Mg и его сплавам увеличивает их прочность. Г. и его эвтектич. сплав с In используется в радиац. контурах реакторов. Предложено использование галлам в качестве теплоносителей в ядерных реакторах, для устройства гидравлич. затворов, плавких предохранителей и т. п.
Г. — малотоксичный элемент. Из-за низкой температуры плавления слитки Г. рекомендуется транспортировать в пакетах из полиэтилена, который плохо смачивается расплавом Г.
Производство Г. в капиталистам, странах ок. 50 т/год (1980).
Существование Г. было предсказано Д. И. Менделеевым в 1871, элемент открыл и выделил П. Э. Лекок де Буабодран в 1875.
Лит.: Шека И. А, Чаус И. С, Мнтюрева Т. Т., Галлий, К., 1963; Еремин Н. И., Галлий, М., 1964; Рустамов П. Г., Халькогениды галлия, Баку, 1967; Дымов А. М., Савостин А. П., Аналитическая химия галлия, М., 1968; Иванова Р. В., Химия и технология галлия, М., 1973; Коган Б. И., Вершковская О.В., Славиковская И.М., Галлий. Геология, применение, экономика, М., 1973; Яценко С. П., Галлий. Взаимодействие с металлами, М., 1974; Процессы экстракции и сорбции в химической технологии галлия, Алма-Ата, 1985; Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, 2 изд., т. 1, М., 1976, с. 223–44; Федоров П. И., Мохосоев М. В.. Алексеев Ф.П., Химия галлия, индия и таллия, Новосиб., 1977.
П. И. Федоров
Значения в других словарях
- галлий — -я, м. Химический элемент, редкий металл серебристо-белого цвета. [От лат. Gallia — Франция] Малый академический словарь
- Галлий — (лат. Gallium) Ga, химический элемент III группы периодической системы Д. И. Менделеева, порядковый номер 31, атомная масса 69,72; серебристо-белый мягкий металл. Состоит из двух стабильных изотопов с массовыми числами 69 (60,5% ) и 71 (39,5%). Большая советская энциклопедия
- галлий — орф. галлий, -я Орфографический словарь Лопатина
- галлий — ГАЛЛИЙ я, м. gallium m. От лат. названия Франции, где был открыт в 1875 г. химиком Лекоком де Буадбодраном. ЭС. Химический элемент, мягкий лекоплавкий серебристо-белый металл... Словарь галлицизмов русского языка
- галлий — Га́лл/ий/. Морфемно-орфографический словарь
- ГАЛЛИЙ — ГАЛЛИЙ (символ Ga), серый металлический элемент III группы периодической системы. Открытие его было предсказано Дмитрием МЕНДЕЛЕЕВЫМ. Был обнаружен благодаря использованию СПЕКТРОСКОПА в 1875 г. Основные источники — бокситы и некоторые цинковые руды. Научно-технический словарь
- Галлий — Ga (лат. Gallium * a. gallium; н. Gallium; ф. gallium; и. galio), — хим. элемент III группы периодич. системы Mенделеева, ат. н. 31, ат. м. 69,73. Cостоит из двух стабильных изотопов 69Ga (61,2%) и 71Ga (38,8%). Предсказан в 1870 Д. И. Mенделеевым. Горная энциклопедия
- галлий — ГАЛЛИЙ -я; м. [от лат. Gallia — Франция] Химический элемент (Ga), мягкий легкоплавкий металл серебристо-белого цвета (применяется в производстве полупроводников). Толковый словарь Кузнецова
- галлий — [< соб.] – хим. ред кий элемент, символ Ga, порядковый номер 31, атомный вес 69,72; мягкий тягучий синевато-белый металл с температурой плавления 30,1°; применяется для изготовления высокотемпературных термометров, а также вместо ртути в технике высокого вакуума Большой словарь иностранных слов
- галлий — галлий м. Химический элемент, мягкий легкоплавкий металл серебристо-белого цвета. Толковый словарь Ефремовой
- ГАЛЛИЙ — ГАЛЛИЙ (лат. Gallium) — Ga, химический элемент III группы периодической системы, атомный номер 31, атомная масса 69,723. Назван от Gallia — латинского названия Франции. Большой энциклопедический словарь
- Галлий — (хим.) Свойства этого элементарного тела, Ga = 69,86, были предсказаны (Д. И. Менделеевым) периодической (см. это слово) системой элементов, как экоалюминия, в 1871 г. В 1875 г. Лекок де Буабодран открыл... Энциклопедический словарь Брокгауза и Ефрона
