бром
БРОМ (от греч. bromos — зловоние; название связано с неприятным запахом Б.; лат. Bromum) Br
хим. элемент VII гр. периодической системы, ат. н. 35, ат. м. 79,904; относится к галогенам. Прир. Б. состоит из стабильных изотопов 79Br (50,56%) и 81Br (49,44%). Конфигурация внеш. электронной оболочки 4s24p5; степени окисления −1 (бромиды), +1 (гипобромиты), +3 (бромиты), +5 (броматы) и + 7 (перброматы); энергия ионизации при последоват. переходе от Вг° до Вг7+ соотв. 11,84, 21,80, 35,90, 47,3, 59,7, 88,6, 109,0, 192,8 эВ; электроотрицательность по Полингу 2,8; атомный радиус 0,119 нм, ионные радиусы Br− (6), Br3+ (4), Br5+ (3), Br7+ (6X Вг7+ (4) соотв. 0,182, 0,073, 0,045, 0,053, 0,039 нм (в скобках указано координац. число).
Молекула Б. двухатомна (в парах обнаружены молекулы Br4), длина связи в молекуле 0,228 нм; энергия диссоциации 190,0 кДж/моль, степень диссоциации 0,16% при 800 °C и 18,3% при 1284 °C
Содержание Б. в земной коре 1,6∙10−4 % по массе (1015–1016 т). Собственно минералы бромаргирит AgBr и эмболит Ag(Cl, Br) редки. Б. находится в природе в рассеянном состоянии, являясь постоянным спутником хлора. Соли Б. легко выщелачиваются и накапливаются в морской воде (0,065% по массе), рассолах соляных озер (до 0,2%) и в подземных рассолах (до 0,1%), обычно связанных с соляными и нефтяными месторождениями. В виде изоморфной примеси Б. содержится в поваренной соли NaCl (0,005–0,03% по массе), сильвине KCl (0,02–0,1%), карналлите КMgCl3*6H2O (0,1–0,39), бишофите MgCl2*6H2O (до 0,6%).
Свойства. При обычных условиях Б. — тяжелая жидкость с резким запахом, в отраженном свете темно-фиолетового, почти черного цвета, в проходящем — темно-красного; легко образует желто-бурые пары; т. пл. −7,25 °C, т. кип. 59,2 °C. Твердый Б. — красно-коричневые игольчатые кристаллы со слабым металлич. блеском, которые при −252 °C становятся бесцветными. Б. кристаллизуется в ромбич. системе, а = = 0,448 нм, b = 0,667 нм, с = 0,872 нм, z = 4, пространственная группа Сета. Плота, твердого Б. 4,073 г/см3 ( −7,3 °C), жидкого — 3,1055 г/см3 (25 °C); tкрит 315 °C, ркрит 10,0 МПа, dкрит 1,26 г/см3; уравнение температурной зависимости давления пара над жидким Б.: lgp(Ha) = −2047,75/T — 0,0061007 + 0,9589*lg T+ 10,76568; C0p 75,69 Дж/(моль∙К); 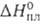 10,58 кДж/моль,
10,58 кДж/моль, 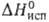 30,86 кДж/моль; S0298 152,0, для газообразного 245,37 Дж/(моль∙К); температурный коэф. объемного расширения 11,0∙10−4 К−1 (273–332 К); теплопроводность 4,5 (25 °C), газообразного 0,21 Вт/(м∙К) при 59 °C;
30,86 кДж/моль; S0298 152,0, для газообразного 245,37 Дж/(моль∙К); температурный коэф. объемного расширения 11,0∙10−4 К−1 (273–332 К); теплопроводность 4,5 (25 °C), газообразного 0,21 Вт/(м∙К) при 59 °C; 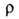 7,69∙1012 Ом∙см;
7,69∙1012 Ом∙см; 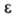 3,148; стандартный электродный потенциал в водном растворе (Br2/Br−) + 1,065 В; уравнение температурной зависимости вязкости для жидкого Б.:
3,148; стандартный электродный потенциал в водном растворе (Br2/Br−) + 1,065 В; уравнение температурной зависимости вязкости для жидкого Б.: 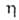 = 1,241∙10−3 (1 + 0,01225t + 2,721∙10−6t2) (Па∙с);
= 1,241∙10−3 (1 + 0,01225t + 2,721∙10−6t2) (Па∙с); 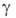 1,5∙10−3 Па (20 °C). Молекулярный Б. диамагнитен. Для спектра Б. характерна широкая полоса поглощения в видимой и УФ-области с максимумом при 420 нм; nD15 1,659.
1,5∙10−3 Па (20 °C). Молекулярный Б. диамагнитен. Для спектра Б. характерна широкая полоса поглощения в видимой и УФ-области с максимумом при 420 нм; nD15 1,659.
Б. раств. в воде (3,58 г в 100 г при 20 °C), в присутствии хлоридов и особенно бромидов растворимость повышается, а в присутствии сульфатов понижается; ниже 5,84 °C из водных растворов осаждаются гранатово-красные кристаллы октагидрата. Растворимость воды в жидком Б. составляет 0,05% по массе. В водных растворах Б. частично гидролизуется: Br2 + H2O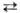 _H+ + Вг− + HBrO; константа равновесия Kр = 5,8∙10−9 (25 °C). Насыщенный водный раствор Б. в воде наз. бромной водой. В конц. H2SO4 и H3PO4 Б. раств. слабо. В растворах щелочей на холоду образует бромид и гипобромит соответствующего металла, а при повышенных температурах — бромид и бромат. Б. смешивается во всех отношениях с большинством орг. растворителей.
_H+ + Вг− + HBrO; константа равновесия Kр = 5,8∙10−9 (25 °C). Насыщенный водный раствор Б. в воде наз. бромной водой. В конц. H2SO4 и H3PO4 Б. раств. слабо. В растворах щелочей на холоду образует бромид и гипобромит соответствующего металла, а при повышенных температурах — бромид и бромат. Б. смешивается во всех отношениях с большинством орг. растворителей.
По реакц. способности Б. занимает промежут. положение между Cl2 и 12. С др. галогенами образует неустойчивые BrF3 (т. пл. 8,8 °C, т. кип. 127 °C), BrF5 (т. пл. −61,3 °C, т. кип. 40,5 °C), BrCl (т. пл. ок. −66 °C, т. кип. ок. −5 °C с разл.) и IBr (т. пл. 41 °C, т. кип. 116 °C), отличающиеся высокой хим. активностью (см. межгалогенные соединения). С O2 и N2 Б. непосредственно не реагирует даже при повышенных температурах, его нестойкие соед. с этими элементами (Br2O, BrO2, Br3O8, NBr3*6NH3) получают косвенными методами. Б. не реагирует также с углеродом. При взаимодействии с S, Se, Те, Р, As и Sb образуются соответствующие бромиды: S2Br2, РBr3, РBr5, неустойчивые SeBr4 и Se2Br2, TeBr4, AsBr3, SbBr3. Бор и Si образуют с Б. при нагревании ВBr3 и SiBr4.
Некоторые металлы (напр., К, А1) энергично взаимод. с сухим Б., но в большинстве случаев из-за образования на поверхности защитной пленки бромида, нерастворимого в Б., реакция энергично идет только в присутствии воды, растворяющей пленку. Стойки к действию Б. Pt и Та, в меньшей степени — Ag, Pb и Ti. С H2 при нагр. Б. образует бромистый водород.
Б. — сильный окислитель, он окисляет в водных растворах I−до I, сульфиты и тиосульфаты — до сульфатов, нитриты — до нитратов, NH3 до N2. Ион Br− в водных растворах бромидов окисляется Cl2, KMnO4, K2Cr2O7, H2O2 до Br2. Из реакций Б. с орг. соед. Наиб. характерны присоединение по кратным связям и замещение водорода (обычно в присутствии кат. или при действии света). Ниже приводятся сведения о некоторых соед. Б.
Б. образует ряд кислородсодержащих кислот. Бромноватистая кислота HBrО существует только в разбавл. водных растворах; является слабой кислотой (pKа 8,69); сильный окислитель; при стоянии диспропорционирует на HBr и HBrO3, в присутствии кат. (Pt, Fe) или под действием света разлагается с выделением O2; получают гидролизом Br2.
Бромистая кислота HBrO2 существует только в водных растворах; в течение 4 ч полностью разлагается; м. б. получена взаимод. AgNO3 с Br2 в воде. Бромноватая кислота HBrO3 существует только в водных растворах, которые м. б. сконцентрированы в вакууме до концентрации 50%; при стоянии и нагревании разлагается; сильная кислота, окислитель; получают при окислении Б. хлором в воде или разложением Ва(BrO3)2 серной кислотой. Бромная кислота HBrO4 известна в водных растворах, которые можно сконцентрировать в вакууме до концентрации 80%; при нагр. разлагается; сильная кислота; в конц. растворах сильный окислитель; м. б. получена пропусканием раствора KBrO4 через H+ — катионит.
Соли HBrО (гипобромиты) устойчивы в щелочных растворах; при pH < 9 и при нагр. превращаются в броматы; в щелочной среде являются сильными окислителями; получают взаимод. Б. со щелочами на холоду. Гипобромит Na получают в виде пента- и октагидратов, К — в виде тригидрата; желтые кристаллы; разлагаются ок. 0 °C; применяются в аналит. химии как реагенты для определения, напр., NH3, аминов. Соли HBrO2 (бромиты)-кристаллы; устойчивы при обычных условиях; разлагаются при нагр.; в нейтральной среде — мягкие окислители; получают взаимод. Б. со щелочами при строго контролируемых pH, температуре и концентрации; NaBrO2 -3H2O — желтые кристаллы; обезвоживается в вакууме при 200 °C; выше 200 °C разлагается на NaBr и O2; применяется для расшлихтовки тканей (удаления крахмала).
Соли HBrO3 (броматы) — бесцветные кристаллы; устойчивы при обычных условиях; броматы щелочных металлов разлагаются при нагр. по схеме МBrO3 → МBr + 1,5O2, др. металлов — по схеме М(BrO3)2 → МО + Br2 + 2,5O2. Для NaBrO3 т. пл. 380 °C; плотн. 3,34 г/см3; растворимость в воде (г в 100г)-36,4 (20 °C), 90,8 (100 °C). Для KBrO3 плотн. 3,25 г/см3; разлагается при 400 °C; растворимость в воде (г в 100 г)-6,9 (20 °C), 49,7 (100 °C). Броматы Na и К получают электрохим. или хим. (действием Cl2) окислением NaBr или KBr, а также взаимод. Б. с NaOH или KOH. Применяются в броматометрии. Ва(BrO3)2 кристаллизуется из водных растворов в виде дигидрата; раств. в воде (0,657 г безводной соли в 100 г при 20 °C); получают обменной реакцией броматов щелочных металлов с BaCl; используется для получения HBrO3.
Соли HBrO4 (п е р б р о м а т ы) — кристаллы, стабильны в обычных условиях, выше 250 °C разлагаются (напр., 2KBrO4 → O2 + 2KBrO3); хорошо раств. в воде; умеренные окислители; получают окислением броматов Na или К фтором в щелочной среде.
Известны оксифториды Б. — сильные окислители и фторирующие агенты. Пербромилфторид (триоксимонофторид брома) BrO3F — бесцветный газ; т. пл. −110,35 °C, т. кип. 2,35 °C; плотн. жидкости 2,2 г/см3; уравнение температурной зависимости давления пара: lgp (мм рт. ст.) = 17,6986 — −3048,45/Т (188–292 К); ΔH0обр 137,4 кДж/моль, 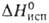 25,3 кДж/моль; S0298 298,7 Дж/(моль∙К). В отсутствие влаги устойчив, в воде полностью гидролизуется до HBrO4 и HF. Получают действием SbF5 на KBrO4 в среде плавиковой кислоты.
25,3 кДж/моль; S0298 298,7 Дж/(моль∙К). В отсутствие влаги устойчив, в воде полностью гидролизуется до HBrO4 и HF. Получают действием SbF5 на KBrO4 в среде плавиковой кислоты.
Бромилфторид (диоксомонофторид брома) BrO2F — бесцв. летучая жидкость; т. пл. −9 °C; для газа C0 62,898 Дж/(моль∙К), S0298 294,11 Дж/(моль∙К). Выше 52 °C разлагается на BrF3, Br2 и O2. В воде бурно гидролизуется до HBrO3 и HF. С фторидами щелочных металлов дает соли с анионом BrO2F2−, с сильными кислотами Льюиса — соли с катионом бромила, напр. BrO2+SbF6−. Получают реакцией BrF5 с KBrO3 в жидком HF или гидролизом BrF5 при низких температурах.
Окситрифторид брома (бромозил трифторид) BrOF3 — бесцветная жидкость; т. пл. ок. 0 °C, при 25 °C давление пара 6,65 Па. При комнатной температуре медленно разлагается на BrF3 и O2. С донорами иона F− дает устойчивые кристаллич. соли типа K + BrOF4, с акцепторами F− — соли с катионом OBrFI, напр. OBrF2+AsF6−. Получают реакцией O2AsF6 с KBrOF4 или действием KrF2 на BrO2F.
Получение. Для получения Б. используют морскую воду, озерные и подземные рассолы, а также щелока калийного производства (концентрация Б. до 4–5 кг/м3), содержащие Б. в виде Br−. Б. выделяют пропусканием Cl2 с послед. отгонкой с водяным паром (при концентрации Б. в растворе более 1 кг/м3) или воздухом в насадочных колоннах из керамики, стекла или Ti. Растворы, имеющие щелочную реакцию, предварительно подкисляют (обычно H2SO4) до pH 2,5–3,0. В верхнюю часть колонны подается подогретый реакционный раствор, снизу — водяной пар и неск. выше — Cl2. Пары, выходящие из колонны, конденсируют. Далее Б. отделяют от воды и очищают от примесей Cl2 и орг. соед. ректификацией. Применение воздуха вместо водяного пара позволяет использовать растворы с содержанием Б. менее 1 кг/м3. Раствор после обработки Cl2 подают в верхнюю часть колонны, снизу — воздух. Из образовавшейся бромвоздушной смеси Б. улавливают раствором FeBr2; получаемый при этом FeBr3 восстанавливают железными стружками до FeBr2. По др. способу к бромовоздушной смеси добавляют SO2, который в присутствии паров воды образует с Б. смесь HBr и H2SO4; Б. выделяют действием Cl2. Для поглощения Б. могут быть использованы растворы NaOH или Na2CO3 (3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + ЗCO2). В этом случае Б. выделяют действием H2SO4. Остаточный Б. в отработанных растворах обезвреживают Na2S2O3.
Определение. Качественно Б. обнаруживают по красно-фиолетовому окрашиванию фуксина, розовому — эозина, желтому — слоя орг. растворителя (напр., CCl4), а также реакцией с флуоресцеином. Количеств. анализ осуществляют иодометрически, аргентометрически, меркуриметрически, а также потенциометрич. титрованием.
Применение. Б. используют для получения бромсодержа-щих неорг. (напр., NaBr, KBr, HBr) и орг. соед. (ок. половины производимого Br2 — в производстве C2H4Br2), Б. и бромную воду применяют в аналит. химии, напр. для кулонометрич. определения As3+, Sb3+, V4+, а также для качеств. и количеств, анализа орг. соединений.
Мировое производство Б. (без СССР) ок. 300 тыс. т/год (1980). Главные производители: США, СССР, Великобритания, Израиль, Франция, ГДР, ФРГ, Италия.
Б. ядовит. При работе с ним пользуются противогазом, перчатками и спецодеждой. При содержании Б. в воздухе ок. 0,001% наблюдаются раздражение слизистых оболочек, головокружение, кровотечение из носа, при 0,02% — удушье, спазмы и заболевание дыхат. путей. ПДК 0,5 мг/м3. Попадание жидкого Б. на кожу вызывает зуд, при длительном действии образуются медленно заживающие язвы. При отравлении Б. пострадавшего нужно вывести на свежий воздух, дать теплое молоко с содой. Кожа, обожженная Б., промывается многократно водой и раствором Na2CO3, смазывается мазью, содержащей NaHCO3. Б. открыт в 1826 Ж. Баларом.
Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974, с. 206–36; Ксензенко В. И., Стасиневич Д. С, Химия и технология брома, иода и их соединений, М., 1979: Егоров Л. Ф., Осыка В. Г., Пивоваров М. Д., Технология получения бромжелеза из природных рассолов, М., 1979; Полянский Н. Г., Аналитическая химия брома, М., 1980; Bromine and its compounds, ed. by Z.E. Jolles, L., 1966; Comprehensive inorganic chemistry, v. 2, Oxf., 1973.
В. И. Ксензенко, Ц. С. Стасиневич
Значения в других словарях
- бром — -а (-у), м. 1. Химический элемент, тяжелая темно-красная жидкость, употребляемая в химии, а также в медицине и фотографии. 2. Лекарство, имеющее в своем составе бромистые соединения, успокаивающее нервную систему. [От греч. βρώμος — дурной запах] Малый академический словарь
- Бром — (лат. Bromum) Br, химический элемент VII группы периодической системы Менделеева, относится к галогенам (См. Галогены); атомный номер 35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Б. открыт в 1826 французским химиком А. Большая советская энциклопедия
- бром — орф. бром, -а и -у Орфографический словарь Лопатина
- бром — I. БРОМ а, м. brome m. <�гр. 1. Химический элемент, тяжелая красно-бурая жидкость с едким запахом, используемая в медицине, фотографии и т. п. БАС-2. После открытия брома фр. ученым... Словарь галлицизмов русского языка
- бром — Бром/. Морфемно-орфографический словарь
- Бром — (Bromum, Br; греч. brōmos зловоние) химический элемент подгруппы галогенов VII группы периодической системы Д.И. Менделеева, ат. номер 35, ат. масса 79,904: тяжелая темно-бурая жидкость с резким запахом; Б. (в т. Медицинская энциклопедия
- БРОМ — БРОМ (символ Вr), летучий, жидкий элемент группы ГАЛОГЕНОВ (седьмая группа периодической таблицы). Впервые выделен в 1826 г. Это единственный из неметаллических элементов, который остается жидким при комнатной температуре. Научно-технический словарь
- Бром — Вr (лат. Bromum * a. bromine; н. Brom; ф. brome; и. bromo), — хим. элемент VII группы периодич. системы Менделеева, ат.н. 35, ат. м. 79,904; относится к галогенам. Природный Б. состоит из двух стабильных изотопов 79Вr (50,56%) и 81Br (49,44%). Горная энциклопедия
- бром — БРОМ -а (-у); м. [от греч. brōmos — дурной запах] 1. Химический элемент (Br), тяжёлая красно-бурая ядовитая жидкость, дымящая на воздухе (используется в химическом производстве, в виде солей — в медицине и фотографии). Соли брома. Микстура с бромом. Толковый словарь Кузнецова
- бром — БРОМ, а, м. Химический элемент, красно-бурая дымящаяся на воздухе едкая жидкость, употр. в химии, а также в медицине, фотографии. | прил. бромистый, ая, ое и бромный, ая, ое. Толковый словарь Ожегова
- бром — БРОМ м. одно из химических начал, стихий, неразлагаемых или простых веществ, по свойствам своим близкое к иоду. Бромовый, состоящий из брома или от него происходящий; бромистый, содержащий в себе несколько брома. Толковый словарь Даля
- бром — Брома, м. [греч. bromos – дурной запах]. Химический элемент буро-красного цвета с резким, неприятным запахом (хим.). Бромистые соединения, применяются в медицине, фотографии и др. Большой словарь иностранных слов
- бром — БРОМ, брома, ·муж. (·греч. bromos — дурной запах). Химический элемент, едкая жидкость буро-красного цвета с сильным запахом (·хим. ). Бром употребляется в медицине, фотографии и технике. | Бромистые соединения, употр. в медицине (·апт. ). Врач прописал мне бром. Толковый словарь Ушакова
- бром — бром м. 1. Химический элемент, тяжёлая красно-бурая жидкость с едким запахом, используемая в медицине, фотографии и т.п. 2. Лекарственный препарат, содержащий это вещество или его соединения (обычно соли), применяемый как успокоительное и снотворное средство. Толковый словарь Ефремовой
- БРОМ — БРОМ (лат. Bromum) — Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Назван от греч. bromos — зловоние. Большой энциклопедический словарь
