азеотропные смеси
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) (от греч. a- — приставка, означающая отрицание или отсутствие к.-л. свойства, 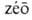 — киплю и
— киплю и 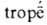 — поворот, изменение)
— поворот, изменение)
жидкие смеси, характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный раствор; поэтому А.с. наз. также нераздельнокипящими. Наличие А. с. существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации.
А. с. встречаются как в двойных, так и в многокомпонентных системах. Некоторые вещества особенно склонны к образованию А.с., особенно с представителями к.-л. одного го-мологич. ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из разл. рядов могут образовывать между собой большое число двух- и многокомпонентных А. с., охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с А. с., что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии. Такие сведения особенно важны для хим. и нефтехим. отраслей промышленности, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с А.с., а технол. процессы часто проводятся при повышенных температурах и давлениях, т. е. вблизи критич. параметров и в закритич. области.
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной температуре (изотермы общего давления) имеют максимумы или минимумы (точки А1, А2, А3 на рис. 1). Соответственно на изобарах температур кипения в этих точках имеются минимумы или максимумы (см. Коновалова законы). При максимуме на изотерме (минимуме на изобаре) азеотроп наз. положительным, при минимуме на изотерме (максимуме на изобаре)-отрицательным. Среди двойных систем с А.с. примерно 93% приходится на системы с положит. азеотропами. Известны случаи существования в одной системе двух азеотропов разного знака при S-образной изобаре температур кипения (напр., в системе фторбензол-бензол).
Составы А.с. изменяются с температурой (давлением). Эта зависимость образует на диаграмме равновесия линию азеотропов (линия LKaз на рис. 1), которая может проходить через всю область равновесия жидкость-пар для данной системы вплоть до критич. кривой, отграничивающей область существования равновесия жидкость — пар в двойной системе, но может заканчиваться и ранее. Вдали от критич. кривой, т. е. при поведении паровой фазы, близком к поведению идеального газа, изменение состава А.с. с температурой определяется соотношением теплот испарения компонентов (см. Вревского законы). Изменение состава А. с. с температурой (давлением) используют для их разделения методом азеотропной ректификации.
А.с. возникают вследствие отклонения поведения системы от поведения, свойственного идеальным растворам. Названия "положительный" и "отрицательный" азеотроп соответствуют положит. и отрицат. отклонениям от идеальности. А.с. могут образовываться даже при весьма малых отклонениях от идеальности, если изобарич. температуры кипения обоих компонентов близки между собой. В этих случаях составы А. с. обычно ближе к эквимолярным, чем при значит. различии температур кипения компонентов, когда А. с. могут располагаться и на концах концентрац. интервала системы, вблизи чистых компонентов. При составе, близком к 100% одного из компонентов, азеотроп наз. тангенциальным или почти тангенциальным.
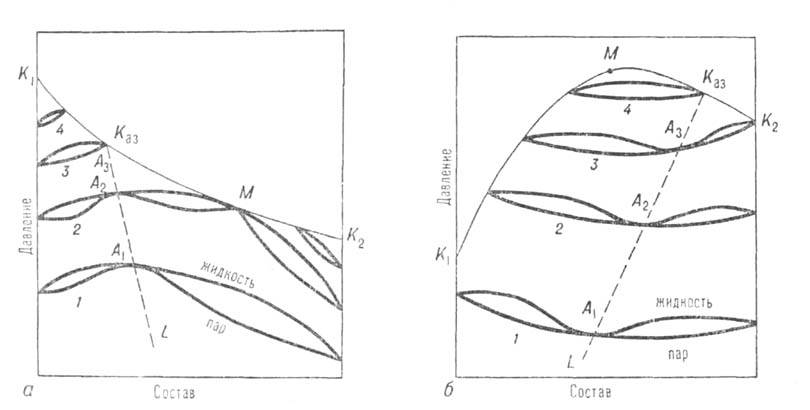
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1–4 — изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; Kаз-критич. точка азеотропа; ЦCаз-линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критич. кривой, соотв. K1KазМK2 и K1МKазK2.
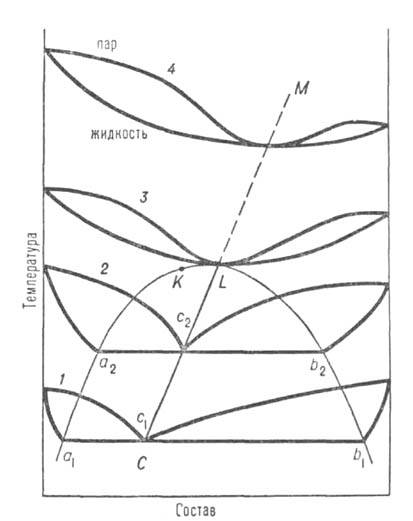
Рис. 2. Диаграмма равновесия жидкость-пар в системе с расслаивающейся жидкой смесью; аКb-пограничная кривая равновесия двух жидких фаз; кривые 1–4 — изобары равновесия; c1, с2-составы пара, равновесного двум жидким фазам a1b1 и а2b2; CL-линия гетероазеотропов.
Общих методов, позволяющих предсказать возможность образования в данной системе А.с. и ее параметры (состав, температуру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
В расслаивающихся жидких смесях, т. е. при трехфазном равновесии жидкость-жидкость-пар, могут существовать т. наз. гетероазеотропы (псевдоазеотропы). В этих случаях составы равновесных паровых фаз (c1,c2 на рис. 2) лежат внутри интервала концентраций равновесных жидких фаз (a1b1, а2b2 на рис. 2). При перегонке двухфазной жидкой смеси любого состава конденсат будет иметь постоянную концентрацию до тех пор, пока в кубе сохраняются обе жидкие фазы. Температура кипения такой смеси при этом ниже температур кипения чистых компонентов. Полная аналогия с описанными выше истинными А. с., или гомоазеотропами, наблюдается лишь при равенстве общего состава двухфазной жидкой смеси составу равновесного с ней пара. При повышении температуры линия составов паровой фазы (линия CL) пересекает пограничную кривую равновесия жидкость — жидкость (точка L); тогда вместо гетероазеотропов в системе появятся гомоазеотропы (линия LM).
Отличит. черты систем с азеотропизмом не исчерпываются существованием в них А.с., главная особенность которой состоит в том, что в термодинамич. отношении она ведет себя как чистое вещество независимо от числа компонентов. Наличие А. с. оказывает влияние на свойства системы и за пределами существования азеотропной смеси. Особенно отчетливо это проявляется в объемном поведении системы. Из-за того что на изотермах общего давления пара имеются экстремумы, изотерма объема для паровой фазы обязательно имеет минимум у систем с положит. азеотропом и максимум у систем с отрицат. азеотропом (точки M1,М2, М3 на рис. 3). При этом составы, соответствующие экстремумам, вследствие неидеальности паровой фазы не совпадают с составами А. с. При положит. азеотропе критич. состояние достигается сначала для смеси и на критич. кривой появляется температурный минимум, в котором равновесие жидкость-пар распадается на две области (точка М3 на рис. 3, а). В одной из них в некотором интервале температур еще сохраняется А.с.; точка соприкосновения линии азеотропов с критич. кривой наз. критич. точкой азеотропа Kаз (рис. 1, а). С повышением температуры эти области постепенно уменьшаются, стягиваясь к критич. точкам чистых компонентов. При отрицат. азеотропе область равновесия жидкость-пар сохраняется при температурах выше критич. температур чистых компонентов, располагаясь в средней части концентрац. интервала (рис. 1, б и 3, б). При дальнейшем повышении температуры эта область стягивается в точку, отвечающую максимуму температуры на критич. кривой (точки М на рис. 3, б).
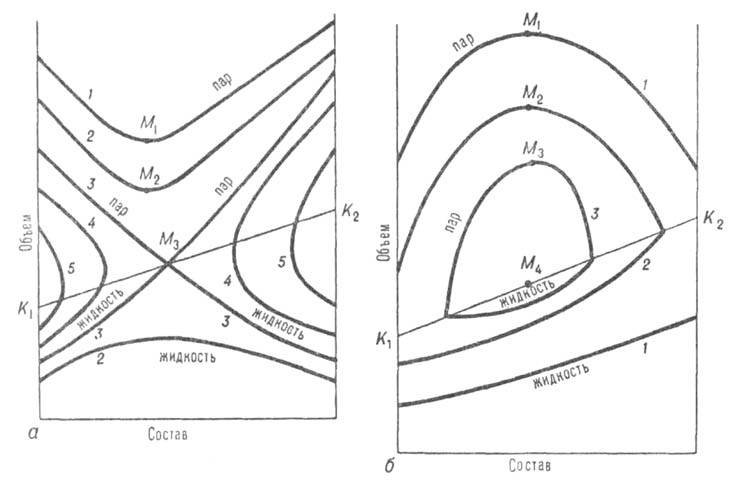
Рис. 3. Диаграммы равновесия жидкость-пар в координатах объем-состав для двойной системы с положит. (а) и отрицат. (6) азеотропами; 1–5 — изотермы равновесия жидкой и паровой фаз; М1, М2, M3-минимумы (а) и максимумы (б) на изотерме паровой фазы; изотерма 3 соответствует температурному минимуму М3(а) и температурному максимуму М4(б) на критич. кривой, соотв. K1M3K2 и K1М4K2.
Термодинамич. поведение систем с А. с. резко отличается от поведения простых систем и в закритич. области. Зависимости объема, энтальпии и энтропии газовой смеси от состава при постоянных температуре и давлении (изотермы-изобары) при составе, близком к Kаз, имеют точки перегиба с вертикальной касательной. Значения этих величин изменяются с концентрацией очень сильно. Так, в системе аммиак-этан мольный объем газовой смеси при ничтожном изменении состава возрастает почти вдвое. Изотермы-изобары вышеуказанных величин проходят, кроме того, через резко выраженные максимумы. Эти и др. особенности систем с А. с. распространяются на значит. интервал температур и давлений в закритич. области. Поэтому использование уравнений состояния, применяемых обычно к газовым смесям в области невысоких температур и давлений, невозможно, если нет сведений о наличии (или отсутствии) в данной системе А. с. и о пределах ее существования.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии А. с. в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах А. с., причем вероятность появления тройного азеотропа тем больше, чем больше число А. с. в двойных системах.
В тройных системах встречаются три типа А. с. Положит. азеотроп характеризуется максимумом на изотермич. повети давления пара (соотв. минимумом на изобарич. поверхности температур кипения) в треугольной диаграмме равновесия (рис. 4). Эта диаграмма показывает зависимость концентраций компонентов, при которых имеется равновесие жидкость-пар, от температуры (при постоянном давлении) или давления (при постоянной температуре). Составы тройной системы представлены концентрац. треугольником. Изобарич. поверхность с1А (1,2)с2А (2,3)с3А (1,3)К для равновесных жидких фаз имеет тройную А. с. в точке К. Концентрация А. с. соответствует точке А (1,2,3) на треугольнике составов. Положит. А. с. образуется в тех случаях, когда в исходных двойных системах имеются только положит. азео-тропы [на рис. 4 каждая двойная система имеет азеотропы в точках А (1,2), А (2,3), А (1,3)]. Отрицат. А. с. образуется, когда в системе имеются только отрицат. двойные азеотропы. Ей соответствует минимум на изотермич. повети общего давления (максимум на изобарич. поверхности температур кипения).
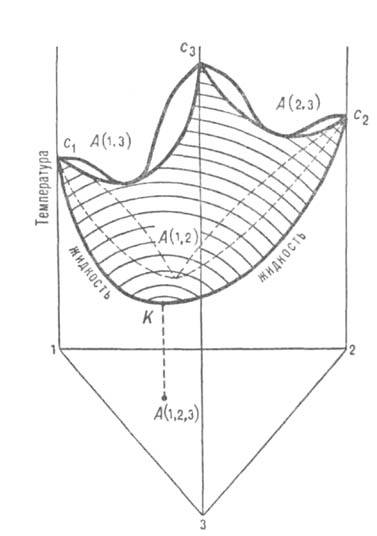
Рис. 4. Диаграмма равновесия жидкость-пар в системе с тройным положит. азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарич. поверхность равновесной жидкой фазы.
Третий тип тройного азеотропа возникает, если в исходных двойных системах имеются азеотропы противоположных знаков. Тогда на изобарич. поверхности температур кипения (изотермич. поверхности общего давления) образуется седловина, хребтовая линия которой имеет экстремум. Система в точке этого экстремума ведет себя как А.с., которая наз. седловинным азеотропом. В зависимости от соотношения числа положит. и отрицат. азеотропов в исходных двойных системах встречаются двуположительно-отрицательные (напр., в системе хлороформ-ацетон-метанол) и, значительно реже, двуотрицательно-положительные (напр., в системе хлороформ — бромистый изопропил — этилформиат) седловинные азеотропы. Встречаются они также и в многокомпонентных системах.
Составы тройных А.с. изменяются с температурой (давлением). Соответствующая зависимость изображается пространств. кривой в изобарич. (изотермич.) призме. Кривая может доходить до критич. поверхности системы, отграничивающей область существования двухфазного равновесия жидкость-пар, но может заканчиваться и ранее. Объемное поведение тройных систем очень сложно. Оно определяется не только наличием тройного азеотропа и его типом, но и типами двойных А. с. в исходных системах, поскольку обусловленные последними особенности свойств не исчезают скачком с прибавлением третьего компонента.
Эксперим. исследования систем с тройными А.с. очень трудоемки. Поэтому большую роль здесь играют теоретич. представления о возможных видах диаграмм состояния. Широко используется для этого правило азеотропии, которое качественно связывает количество и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарич. поверхности температур кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
Лит.: Свентославский В., Азеотропия и полиазеотропия, пер. с англ., М., 1968; Огородников С.К., Лестева Т.М., Коган В. Б., Азеотропные смеси. Справочник, Л., 1971; Маленко Ю.И., Молодснко П. Я., Диаграммы трехкомпонентных азеотропных систем, Л., 1975; Казакова Н. Е., Системы с азеотропизмом при высоких давлениях, М., 1978; Хазанова Н. Е., Соминская Е.Э., Захарова А.В., "Ж. физ. химии", 1981, т. 55, № 10, с. 2640–42.
Н. Е. Хазанова
