химический потенциал
хими́ческий потенциал
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
термодинамич. параметр μ, характеризующий состояние хим. и фазового равновесия в макроскопич. системе. Наряду с давлением р, температурой T и др. параметрами Х. п. относится к интенсивным величинам, т. к. не зависит от массы системы (см. параметры состояния). Наиб. употребительно определение Х. п. ι-го компонента как первой производной энергии Гиббса G системы по числу молей и,-этого компонента при постоянстве чисел молей всех остальных компонентов, температуры T и давления р: (1)
Поскольку для энергии Гиббса числа молей компонентов H1, ..., пк (к — число компонентов в системе) являются единственными экстенсивными переменными, справедливо соотношение: (2)
Т.обр., по определению, Х.п. есть парциальная молярная энергия Гиббса (см. парциальные молярные величины). Для однокомпонентной системы μ, = Glnb т. е. Х. п. равен молярной энергии Гиббса.
Возможно определение Х. п. »-го компонента как изменение любого другого термодинамич. потенциала при изменении числа молей л, — энергии Гельмгольца F, энтальпии Н, внутр. энергии U:
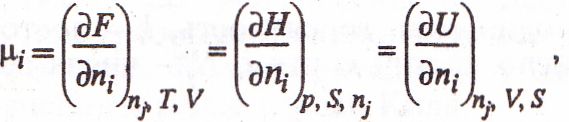
где V — объем системы, S — энтропия. Однако соотношение типа (2) для потенциалов F, UnHne имеют места.
В состоянии термодинамического равновесия однофазной системы каждый из компонентов характеризуется одним и тем же Х. п. во всем объеме. Для r-фазной системы фазовое равновесие определяется условиями;

то есть Х. п. любого из компонентов одинаков во всех фазах, где данный компонент присутствует. Если для двух фаз 1 и 2 Pi > μ?, имеет место перенос компонента из фазы 1 в фазу 2. Если такой перенос невозможен, напр. из-за разделения фаз не проницаемой для компонента мембраной, между фазами 1 и 2 возникает осмотич. давление (см. осмос).
В системе, где между компонентами А,- (исходные вещества) происходит химическая реакция с образованием компонентов Bj- (продукты) типа Σν,μΛ -"~^-Σν,μΒ (ν,∙, νу — стехиометрич. коэф.), устанавливается химическое равновесие, если выполняется условие:
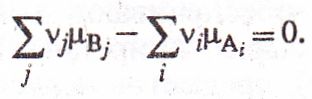
Если Σν;μΛι > Σν;μΒ, в системе увеличивается содержание продуктов Bj (прямая реакция); если Σν,∙μΑι < XvypBj продукты реакции превращаются в исходные вещества (обратные реакции). Величина А = Σν;∙μΒ — Σν,-μΑ наз. химическим сродством данной реакции. ; ' 1
Важнейшей термодинамич. закономерностью является концентрационная зависимость Х.п. В случае идеального газа Х. п. определяется парциальным давлением компонента i согласно уравнению:
μ, = μ“ι +RTinph
где R — универс. газовая постоянная.
Для реальных систем подобная форма записи концентрац. зависимости Х.п. получается при использовании летучести компонента f (реальные газы) или термодинамич. активности Oi (растворы):
Mi = М/д + RTlnfi; P1 = P^3H-Rrinai.
Для идеального раствора справедливо соотношение:
P1 = Pg4H-Rrinxi,
где Xi — молярная доля г'-го компонента. В этих соотношениях μ“1; р?2, μ,;3, μ∙4 — Х. п. /-го компонента в определенным образом выбранном стандартном состоянии [в стандартном состоянии Pi (или f, ait Xi) равно 1].
Особый случай представляют электрохим. системы, где присутствуют заряженные частицы, а в потенциалы G, Н, F, U для данной фазы вносит вклад электростатич. энергия (ре (е — заряд фазы, φ — внутр. потенциал фазы). Для таких систем Х. п. заменяется во всех уравнениях на электрохимический потенциал р,∙:
Mi = Pi H- Φζ,<�ρ,
где Zi — зарядовое число частиц сорта /, Ф — постоянная Фарадея.
В статистической термодинамике для определения Х. п. используется соотношение:
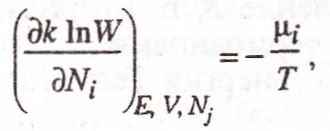
где W — термодинамич. вероятность, к — постоянная Больцмана, Ni — число частиц сорта /, Щ — числа всех остальных частиц.
Термодинамич. вероятность ЩЕ, N1, ..., Nk) равна числу возможных состояний системы, при которых последняя обладает внутр. энергией E и содержит Nu .... Nk частиц соответствующих сортов. Равновесие двух систем А и В, определенное равенством Х.п. р^ = р?, ..., P4=P? и условием Ta = Tb, соответствует наиб. вероятному распределению энергии E между А и В. Если система В представляет собой обширный тепловой резервуар (ЕВ^>ЕА) и обширное хранилище частиц (Nf^Nfi), Х.п. и температура определяют плотность вероятности нахождения системы А в состоянии с заданной энергией при заданных числах частиц всех сортов (большое канонич. распределение Гиббса).
Понятие Х. п. может быть использовано для характеристики локального термодинамич. равновесия системы, которая в целом неравновесна. При локальном равновесии малые элементы объема приближенно рассматриваются как равновесные и учитывается обмен энергией (энтропией) между ними. Локальное термодинамич. равновесие — одно из основных понятий термодинамики неравновесных процессов.
Х. п. используется в ряде соотношений физ. химии. Среди них:
1) уравнение Гиббса — Дюгема для однофазной к-компонентной системы при постоянных давлении и температуре:
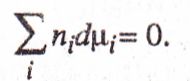
2) Уравнение, связывающее константу равновесия хим. реакции К и изменение стандартной энергии Гиббса ΔG®:
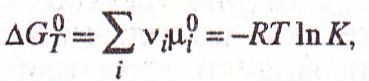
где Vi — стехиометрич. коэф. веществ, участвующих в реакции.
3) Уравнение, связывающее поверхностное натяжение σ с адсорбциями компонентов F1, ..., Г,∙:
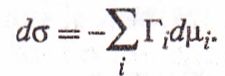
Х. п. выражают в Дж/моль (в статистич. термодинамике — в Дж/частица). Термин введен Дж. Гиббсом в 1874–78.
Лит. см. при ст. Статистическая термодинамика, химическая термодинамика.
М. В. Коробов
Значения в других словарях
- Химический потенциал — (μi) термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, Х. п. определяется как приращение внутренней энергии (См. Большая советская энциклопедия
- ХИМИЧЕСКИЙ ПОТЕНЦИАЛ — Термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа ч-ц в системе и необходимая для описания св-в открытых систем (с перем. числом ч-ц). X. Физический энциклопедический словарь
- ХИМИЧЕСКИЙ ПОТЕНЦИАЛ — ХИМИЧЕСКИЙ ПОТЕНЦИАЛ — понятие, используемое для описания термодинамического равновесия в многокомпонентных системах... Большой энциклопедический словарь
