фторорганические соединения
ФТОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат в молекуле связи С — F. В зависимости от числа атомов F в молекуле Ф. с. условно разделяют на монофторированные, поли-фторированные и перфторированные (все атомы H замещены HaF).
Первые Ф. с. были синтезированы в 19 в., интенсивное развитие химии этих соед. приходится на 40-е гг. 19 в. Среди Ф. с. представлены аналоги почти всех типов орг. соед.
Введение атома F часто резко изменяет свойства орг. соед. Это обусловлено природой атома фтора: его высокой электроотрицательностью, малым размером атома (ван-дер-ваальсов-ский радиус всего на 10% больше, чем у H), способностью электронов к разл. типам сопряжения. Связь C — F характеризуется малым межатомным расстоянием, энергия связи превышает энергию связей C — H и C — Cl. Оощее свойство Ф. с. — уменьшение межатомного расстояния с увеличением числа атомов F в молекуле.
При замещении атомов H на F молекулярная масса орг. соед. значительно увеличивается, а температуры кипения и плавления почти не изменяются (напр., у гексафторбензола т. кип. 80 °C). Перфторалканы (часто наз. фтору глероды), начиная с C5, кипят при более низкой температуре, чем соответствующие алканы. Плотность и вязкость у них выше, а показатель преломления и диэлектрич. проницаемость ниже, чем у соответствующих углеводородов. Атомы F изменяют электронную плотность в молекуле Ф. с., что приводит к изменению кислотных свойств и даже к обращению полярности двойной связи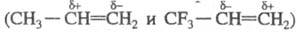 . Высокая энергия связи C — F, а также плотная и объемная оболочка из атомов F, изолирующая углеродную цепь от внеш. хим. воздействий, способствуют высокой термо- и хим. стойкости Ф. с.
. Высокая энергия связи C — F, а также плотная и объемная оболочка из атомов F, изолирующая углеродную цепь от внеш. хим. воздействий, способствуют высокой термо- и хим. стойкости Ф. с.
В ИК спектрах Ф. с. присутствует характеристич. полоса при 1300–1000 см−1, соответствующая валентным колебаниям связи C — F, диапазоны хим. сдвигов Ф. с. в спектрах ЯМР 19F представлены на рис. В масс-спектрах перфторалкилсодержащих соед., прежде всего перфторалканов, фторир. эфиров, перфтор-1,3-дикетонов и др., наблюдается пик иона CF3+ с мол. м. 69. Другие ионы-гомологи, как правило, не дают интенсивных пиков.
Хим. свойства Ф. с. определяются природой углеродного скелета и наличием атома F. Фторуглероды химически инертны и термически устойчивы. При обычной температуре они подвергаются только действию Na в NH3, разлагаются щелочными металлами и SiO2 при 400–500 °C, термич. разложение начинается при 700–800 °C. Также инертны простые фторир. эфиры и фторир. третичные амины. Ненасыщ. фторир. системы (фторолефины, гексафторбензол) высокореакционноспособ-ны, причем по характеру взаимод. с другими соед. они резко отличаются от олефинов и ароматич. соед. Они легко реагируют с нуклеоф. соед. (спиртами, аминами, NH3), вступают в реакции циклодимеризации и циклоприсоединения, что не типично для олефинов. По отношению к сильным электрофилам фторолефины ведут себя как нуклеофилы. Реагируют с веществами, образующими своб. радикалы (напр., N2O4, FNO, N2F4, CF3I). Некоторые фторолефины (напр., тетрафторэтилен) легко полимеризуются (см. фторопласты), гексафтор-пропилен не образует гомополимеров, но сополимеризуется с рядом фторолефинов, перфторизобутилен не полимеризуется и не сополимеризуется.
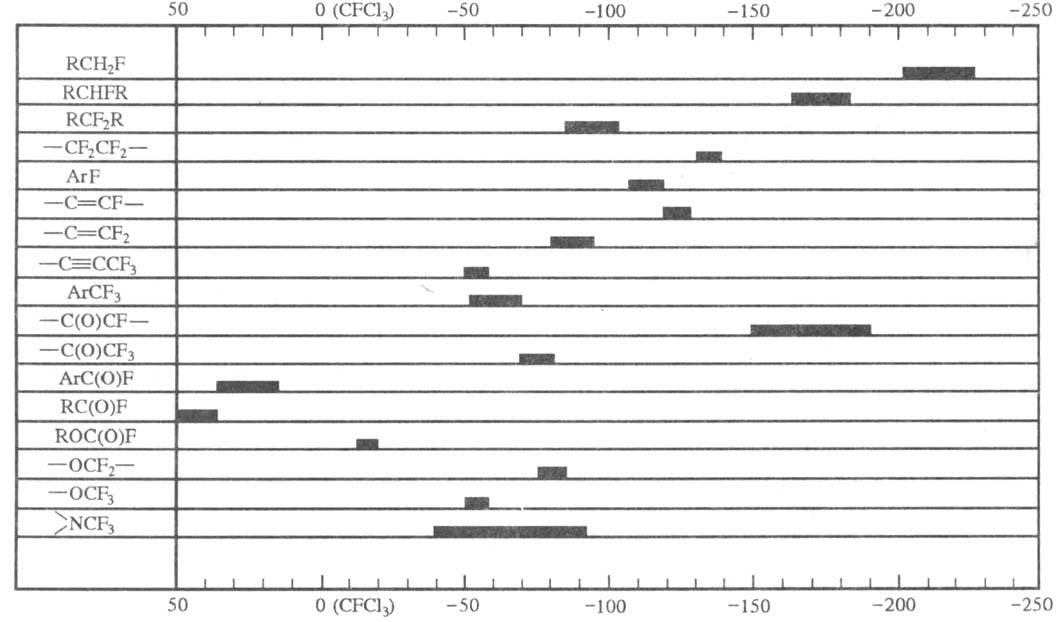
Химические сдвиги в спектрах ЯМР 19F.
Атом F в молекуле сильно влияет на свойства расположенных рядом с ним функц. групп. Карбонильная группа в частично и полностью фторир. альдегидах и кетонах является электро-нодефицитной, поэтому эти соед. более реакционноспособны по отношению к нуклеофилам и более пассивны по отношению к электрофилам, чем их углеводородные аналоги (см., напр., гексафторацетон). Для частично фторир. альдегидов и кетонов характерны высокое содержание енольных форм и склонность к образованию внутрикомплексных соед. (см. полифтор-β-дикетоны).
Первичные и вторичные спирты, содержащие группу OH непосредственно у фторир. атома С, как правило, нестабильны; теряя HF, они превращаются во фторкарбонильные соед. Спирты формулы RFCH2OH (RF — перфторир. радикал) стабильны. Фторир. спирты обладают более кислыми свойствами, чем их углеводородные аналоги. Благодаря склонности к образованию водородной связи фторир. спирты образуют прочные комплексы с акцепторами протона и служат растворителями для полярных полимеров (см. спирты полифторированные).
Гетероатомы (N, О, S), связанные с фторалкильной группой, теряют большую часть своей основности. Насыщенные алифатич. и циклич. перфторэфиры, за исключением пер-фторэпоксидов, химически и термически стабильны; пер-фторэпоксиды высокореакционноспособны (см. перфторолефинов окиси).
Присутствие атома F в карбоновых кислотах повышает их кислотность. Так, для CF3COOH рKа 0,23 (для CH3COOH рKа 4,74). Введение атома F в амины уменьшает их основность. Перфорир. трет-амины, подобно перфторир. эфирам, инертны и термически стабильны. Они не образуют солей или комплексов с сильными кислотами и не подвергаются действию большинства окислителей. В перфторир. трет-аминах [напр., N(C4F9)3] хорошо раств. O2, N2 и CO2, что позволяет использовать их как газопереносящие среды в рецептурах "искусственной крови".
В ароматич. ядре атом F направляет заместитель в пара-положение, перфторалкильные группы — в мета-положение. При реакции фторсодержащих ароматич. соед. с нуклеофилами сначала замещается один атом F, а затем второй — в пара-положение к первому. Пентафторбензол образует магнийорг. соед., вступающее обычным образом в реакции Гриньяра. Из ароматич. соед., содержащих F в боковой цепи, наиб. значение имеют бензотрифториды, применяемые для синтеза стойких красителей, фармацевтич. препаратов и пестицидов.
О способах введения атома F в орг. соед. см. фторирование.
Атом F благодаря близости по размеру атому H может имитировать последний в живом организме. Вследствие этого многие частично фторир. орг. соед. обладают физиол. активностью и используются при создании новых лек. препаратов и пестицидов. Так, гексафторбензол исследован как ингаляционный анестетик в ветеринарии; фторбензол, дифторбензол, полициклич. фторароматич. соед. — полупродукты в синтезе фармацевтич. и пестицидных препаратов; 5-фторурацил используется в хемотерапии рака.
Ф. с. применяют во мн. областях промышленности: на основе фторопластов получают промышленно важные фторволокна и фторкаучуки, из фторангидридов карбоновых и сульфокислот и олигомеров гексафторэтилена — фторированные поверхностно-активные вещества. Ф. с. используют как стойкие смазочные, антифрикционные, изолирующие, водо- и масло-отталкивающие материалы; насыщ. алифатич. Ф. с. — хладагенты (см. хладоны).
Ф. с. служат для изучения фундам. теоретич. вопросов химии: природы кратной и водородной связи, механизма реакций, природы межмол. сил и др.
Лит.: Шеппард У., Шартс К., Органическая химия фтора, пер. с англ., М., 1972.
А. В. Фокин
Значения в других словарях
- Фторорганические соединения — Органическое соединения, содержащие в молекулах одну или несколько связей F—C. Химия Ф. с. начала интенсивно развиваться лишь со 2-й половины 20 в., но уже выросла в большую специализированную область органической химии (См. Органическая химия). Большая советская энциклопедия
- ФТОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — ФТОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле один или несколько атомов фтора, непосредственно связанных с атомом углерода. Фторорганические соединения — смазочные масла, гидравлические жидкости, фторопласты, фторкаучуки, фреоны, красители... Большой энциклопедический словарь
