нитрозамины
НИТРОЗАМИНЫ (N-нитрозоамины)
соед. общей формулы RR'NNO (R, R'= Alk, Ar). Первичные Н. (R = Н) существуют лишь при температуре ниже 0 °C. Известны также N-нитрозоамиды общей формулы RN(X)NO (X = CONH2, CO2Alk и др.).
Н. — жидкости или твердые вещества желтого цвета (см. табл.), раств. в воде и мн. органических растворителях, при обычной температуре устойчивы лишь огранич. время. Атомы в молекуле Н. расположены в одной плоскости. В N-нитрозодиметиламине длина связей N—N 0,134 нм, N—О 0,124 нм, угол NNO 119°. Большой барьер вращения вокруг связи N—N (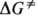 75–160 кДж/моль) позволяет разделять Е- и Z-изоме-ры. В ИК спектрах Н. присутствуют две характеристич. полосы при 1430–1530 (N=O) и ок. 1000 см−1 (N—N). В УФ спектре lмакc 360 нм (e
75–160 кДж/моль) позволяет разделять Е- и Z-изоме-ры. В ИК спектрах Н. присутствуют две характеристич. полосы при 1430–1530 (N=O) и ок. 1000 см−1 (N—N). В УФ спектре lмакc 360 нм (e 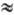 100) и 230–255 нм (e
100) и 230–255 нм (e 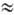 5000), отвечающие n → p* и p → p*-переходам соответственно. В спектрах ПМР сигнал a-Н-атома цис-изомера сдвинут в более сильное поле по сравнению с соответствующим сигналом транс-изомера на 0,2–0,6 м. д. В спектрах ЯМР на ядрах N хим. сдвиг dN ок. 200 м. д. (N=O) и —150м. д. (аминогруппа).
5000), отвечающие n → p* и p → p*-переходам соответственно. В спектрах ПМР сигнал a-Н-атома цис-изомера сдвинут в более сильное поле по сравнению с соответствующим сигналом транс-изомера на 0,2–0,6 м. д. В спектрах ЯМР на ядрах N хим. сдвиг dN ок. 200 м. д. (N=O) и —150м. д. (аминогруппа).
СВОЙСТВА НЕКОТОРЫХ N-НИТРОЗАМИНОВ И N-НИТРОЗОАМИДОВ

Мн. восстановители (H2/Pt или H2/Pd, LiAlH4 и др.) превращают Н. в несимметричные гидразины, в более жестких условиях (под действием H2 над Ni-Ренея или амальгамы Na) происходит разрыв связи N—N и образуются вторичные амины. Дитионит Na дезоксигенирует Н., образуя диалкиламинонитрены 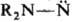 (см. нитрены); HNO3 или CF3CO3H окисляют их в соответствующие N-нитрамины. Под действием ангидридов орг. кислот или HCl Н. соотв. ацилируются или хлорируются с разрывом связи N—N. Сильные алкилирующие агенты взаимод. с Н. по атому кислорода группы NO, напр.:
(см. нитрены); HNO3 или CF3CO3H окисляют их в соответствующие N-нитрамины. Под действием ангидридов орг. кислот или HCl Н. соотв. ацилируются или хлорируются с разрывом связи N—N. Сильные алкилирующие агенты взаимод. с Н. по атому кислорода группы NO, напр.:
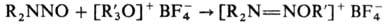
При парофазном фотолизе Н. разрывается связь N—N, при этом генерируется радикал  ; в жидкой фазе в присутствии кислот Н. фотолитически присоединяются к алкенам, напр.:
; в жидкой фазе в присутствии кислот Н. фотолитически присоединяются к алкенам, напр.:
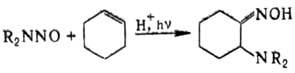
Ароматические Н. в присутствии кислот претерпевают внутримол. перегруппировку с образованием и-нитрозоариламинов. N-Нитрозоамиды под действием NH3 или оснований дают диазосоед., напр.:
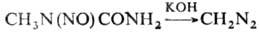
Общий метод синтеза Н. — нитрозированяе вторичных аминов или амидов с помощью NaNO2 (в слабокислой среде), N2O3, N2O4, NO2BF4, N-нитрозо-3-карбазола и др. агентов. Н. получают также реакцией вторичных аминов с NaNO2 и CH3O или хлоралем, напр.:
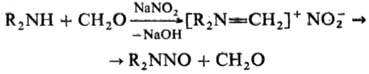
Иногда используют реакцию R2NCOCl с AgNO2 или восстановление N-нитроаминов Al в щелочной среде.
Н. используют для извлечения вторичных аминов из смесей, в синтезе лек. препаратов и орг. красителей, в лаб. практике для получения диазоалканов.
Н. — высокотоксичные соед., они поражают печень, вызывают кровоизлияния, конвульсии, кому. Большинство Н. — сильные канцерогены, некоторые из них оказывают действие уже при одноразовой экспозиции. Н. — сильные мутагены, легко метаболизируются, в организме действуют гл. обр. как алкилирующие агенты, N-нитрозо-N-метилмочевина обладает противоопухолевой активностью.
Лит.: Химия нитро- и нитрозогрупп, пер. с англ., т. 1, М., 1972, с. 100–19; т. 2, М., 1973, с. 156–210; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 449–59; Костюковский Я.Л., МаламедД.Б., "Успехи химии", 1988, т. 57, в. 4, с. 625–55.
С. Л. Иоффе
