борогидриды металлов
БОРОГИДРИДЫ МЕТАЛЛОВ (боранаты, тетрагидридобораты, тетрагидробораты)
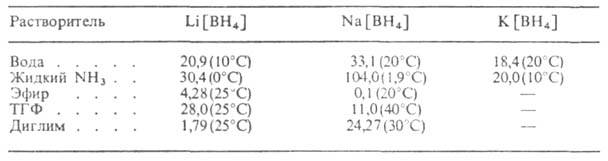
комплексные соед., содержащие группу [BH4]. Последняя имеет тетраэдрич. конфигурацию, межатомные расстояния В—Н равны 0,12–0,13 нм. В зависимости от природы связи группы [BH4] с металлом М различают ионные Б.м. (М — щелочной или щел.-зем. металл) и ковалентные (М — Be, A1 или переходный металл). Ионные Б. м. — бесцветные кристаллы (табл. 1). Раств. в воде, жидком NH3, аминах и некоторых др. полярных растворителях (табл. 2), особенно хорошо — в эфирах этиленгликолей (диглиме, триглиме, тетраглиме). В растворах образуют сольваты, напр. Li[BH4]*O(C2H5)2, Na[BH4]*nHCON(CH3)2 (n = 1, 2, 4). Число связанных молекул растворителя редко превышает 4. Большинство молекул сольватов довольно прочно, и их разложение требует жестких условий (нагревание, вакуум).
Табл. 1 — СВОЙСТВА ВОРОГИДРИДОВ МЕТАЛЛОВ
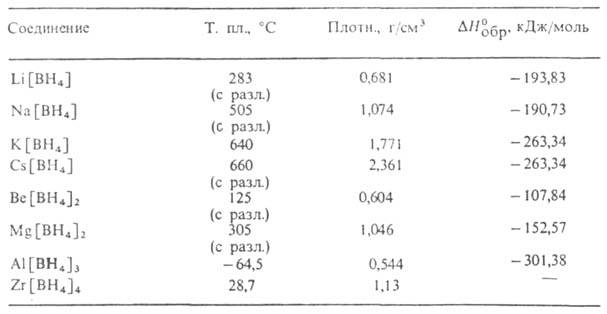
Табл. 2 — РАСТВОРИМОСТЬ БОРОГИДРИДОВ МЕТАЛЛОВ (в воде-% по массе, в остальных растворителях — г в 100 г)
Молекулы растворителя могут присоединяться как к катиону, так и к [BH4]− благодаря водородным связям.
В водном растворе ионные Б. м. постепенно гидролизуются, выделяя H2 (особенно быстро, когда М — щел.-зем. металл); в спиртовых растворах реагируют со спиртами, образуя М [B(OR)4] и H2. Эти реакции можно существенно замедлить введением в раствор щелочи. Ионные Б. м. гигроскопичны, медленно окисляются во влажном воздухе (кроме К [BH4]). Обладают сильным восстанавливающим действием. Атомы водорода в [BH4]− м. б. замещены группами Alk, Ar, AlkO, OH, NH2, атомами галогенов и др. К [BH4]−могут присоединяться группы BHx, при этом образуются, напр., М[В3H8], M[B2H7], которые также относят к Б. м.
• см. также натрия борогидрид
Ковалентные Б. м. — кристаллы или жидкости. Молекулы содержат трехцентровые двухэлектронные мостиковые связи В—Н—М. Большинство из этих Б. м. существует только при низких температурах или в виде сольватов. Легко окисляются на воздухе (многие склонны к самовоспламенению), бурно реагируют с водой и кислотами с выделением H2. Обладают сильным восстанавливающим действием. Раств. в жидком NH3 и полярных органических растворителях, причем растворимость в органических растворителях растет с увеличением ковалентности связи М—[BH4]. Борогидриды переходных металлов и А1 образуют с борогидридами щелочных и щел.-зем. металлов двойные Б. м., напр. М [Zn (BH4)3], M2[Ti(BH4)6], M[A1(BH4)4]. Б. м. получают:
1) взаимод. В2H6 с гидридами, амидами, гидроксидами, алкоголятами металлов, а также с металлоорг. соед., напр.:
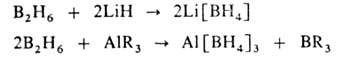
2) реакцией гидридов металлов с ВНа13, эфирами H3BO3, В2O3, мета- и тетраборатами щелочных металлов, с аминоборанами, напр.:
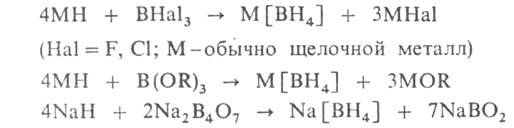
3) обменной реакцией борогидрида Na или Li с гидроксидами, галогенидами и алкоголятами др. металлов в среде сольватирующего растворителя, напр..
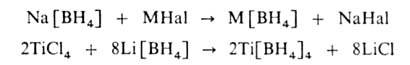
Последний метод наиб. удобен для получения Б. м. переходных металлов. Б. м. определяют, измеряя объем выделяющегося H2 при их разложении разб. соляной кислотой. Известны методы определения с использованием окислителей КIO3 и NaCIO, а также аргентометрический. Качеств. обнаружение [BH4]− основано на восстановлении солей некоторых переходных металлов (Ni, Ag и др.).
Б. м. применяют для селективного восстановления групп C=O, NO2 и C=N в орг. синтезе (напр., при пром. синтезе антибиотиков, витаминов, стероидных препаратов); для восстановления солей при получении металлич. высокодисперсных катализаторов, металлич. покрытий на металлах и керамике, а также гидридов Ge, Sn, As, Sb, используемых в производстве полупроводниковых материалов; в качестве восстановителей в аналит. химии; для синтеза борорг. соед., боразола, боридов, В2H6 и др. Б.м. — удобно транспортируемые источники водорода.
Работа с Б. м. проводится в условиях, предотвращающих их контакт с O2 и влагой воздуха (в сухой камере, в атмосфере инертного газа), а также с такими веществами, как AlCl3, ВНа13. Последние образуют с Б. м. легковоспламеняющиеся и токсичные соединения.
Лит.: Жигач А.Ф., Стасиневич Д.С., Химия гидридов, Л., 1969; Хайош А., Комплексные гидриды в органической химии, пер. с нем.. Л., 1971.
Н. Т. Кузнецов
Значения в других словарях
- БОРОГИДРИДЫ МЕТАЛЛОВ — БОРОГИДРИДЫ МЕТАЛЛОВ — соединения общей формулы M(BH4)n, где M — металл в степени окисления n. Наибольшее значение имеют борогидриды щелочных металлов: кристаллы, растворяются в воде, разлагаются с выделением H2. Большой энциклопедический словарь
