натрия борогидрид
НАТРИЯ БОРОГИДРИД (тетрагидридоборат натрия) NaBH4
бесцветные кристаллы с кубич. гранецентрированной решеткой (а = 0,6164 нм, z = 4, пространственная группа Fm3m); ниже −80 °C переходит в тетрагон. модификацию (а = 0,4354 нм, с = 0,5907 нм); т. пл. 505 °C (с разл.); плотн. 1,074 г/см3; С0р 2,3 кДжДкг∙К); ΔH0обр −190 кДж/моль, DG0298 −119,5 кДж/моль; S0298 101,4 Дж/(моль∙К). Хорошо раств. в полярных растворителях, не раств. в диэтиловом эфире, диок-сане, углеводородах; растворимость (г в 100 г): в воде-40,6 (0 °C), 56 (25 °C), в жидком NH3-99 ( −22,5 °C), гидразине-25,4 (25 °C), ТГФ — менее 0,1, ДМСО — 5,8 (25 °C), ДМФА -18, этаноле-4,0 (20 °C, с медленным разложением). В водных растворах Н. б. постепенно гидролизуется, образуя Na3BO3 и H2, в щелочных растворах гидролиз замедляется, в кислых — значительно ускоряется; в присутствии орг. кислот, солей переходных металлов скорость гидролиза резко увеличивается. Из воды ниже 36,3 °C Н. б. кристаллизуется в виде дигидрата NaBH4-2H2O, выше этой температуры — в виде безводной соли. В системе NaBH4-NH3 образуются аммиакаты NaBH4∙nNH3, где п = 3, 4, 5, конгруэнтно плавящиеся соотв. при −16 и — 20,6 °C. Гидразин, ДМФА, пиридин также образуют с Н. б. сольваты.
По химическим свойствам Н. б. — типичный представитель борогидридов металлов. Окисление Н. б. на воздухе начинается при 300 °C, при этом образуются вода и NaBO2. Кристаллический Н. б. с хлоридами металлов в зависимости от их природы взаимод. с образованием соответствующего боро-гидрида или диборана и металла (или гидрида) либо борида. В неводных растворителях Н. б. реагирует с галогенидами металлов I, II, III гр. и лантаноидов с образованием борогидри-дов; борогидриды переходных металлов образуются в присутствии комплексообразователя (напр., R3P).
Получают Н. б. взаимод. NaH или Na и H2 с разл. соед. В:
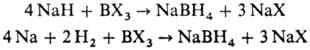
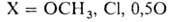
Др. группа способов основана на использовании диборана, напр.:
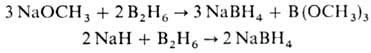
Н. б. используют как селективный восстановитель в орг. (для восстановления групп C=O, C=N, NO2, напр. при пром. производстве антибиотиков, витаминов, стероидных препаратов) и неорг. синтезе, для получения бороводородов, борогидридов и гидридов др. металлов, катализаторов гид-рирования, для нанесения металлич. покрытий на разл. поверхности из водных растворов, как порообразователь для пластиков.
Н. б. токсичен при приеме внутрь, раздражает кожу. Особенно опасна пыль Н.б. Раздражают кожу также растворы Н.б. в жидком NH3, аминах и др.
Лит.: Жигач А.Ф., Стасиневич Д.С., Химия гидридов, Л.. 1969; Мальцева Н.Н., Хаип B.C., Борогидрид натрия, М., 1985.
А. И. Горбунов, П. А. Стороженко
