электрофильные реакции
ЭЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ
гетеролитич. реакции орг. соед. с электроф. реагентами (электрофилами, от греч. elektron — электрон и phileo — люблю). К электрофилам относят ионы и молекулы, которые имеют достаточно низкую по энергии вакантную орбиталь (льюисовские кислоты) — H+, D+, Li+, Alk+, AlAlk3, Hal+, BF3, SO3H+, NO+, NO+2 и др. — и при реакции с субстратом акцептируют на нее оба связывающих электрона.
В основе Э. р. лежит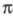 -электронодонорная способность олефинов, ацетиленов и ароматических углеводородов по отношению к электрофилам, а также возможность передачи гетероатомами и простыми связями С — С и С — Н своих электронных пар.
-электронодонорная способность олефинов, ацетиленов и ароматических углеводородов по отношению к электрофилам, а также возможность передачи гетероатомами и простыми связями С — С и С — Н своих электронных пар.
К реакциям электроф. замещения в алифатич. ряду относятся реакции обмена металлов (гл. обр. ртути) в металлоорг. соед. на другой металл, водород или галоген; водородно-дейтериевый обмен; реакции изомеризации и др.
Возможны три механизма реакций: мономолекулярный SE1 и бимолекулярные SE2и SE i:
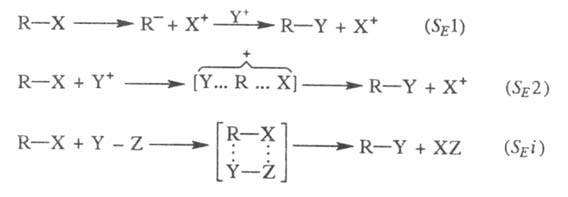
В этих реакциях Y+ — электрофил, Х+ — электронодефицитная уходящая группа, наз. электрофугом (от лат. fugio — убегаю).
При мономол. процессе SE1происходит ионизация субстрата с образованием карбаниона (эта стадия обычно определяет скорость реакции), а затем быстрая стадия связывания карбаниона с электрофилом. В ходе реакций по этому механизму происходит, как правило, рацемизация, хотя в некоторых случаях возможно сохранение или даже обращение конфигурации.
В реакциях, протекающих по механизму SE2, возможна атака электрофила со стороны уходящей группы (при этом конфигурация субстрата сохраняется) и с противоположной стороны (конфигурация обращается). В первом случае уходящая группа может отделяться одновременно с образованием новой связи (механизм SEi); в этом случае также наблюдается сохранение конфигурации.
Механизм электроф. замещения зависит от природы, субстрата и растворителя, как и в случае нуклеоф. замещения. Повышение полярности растворителя увеличивает возможность ионизации в реакциях, протекающих по механизму SE1, а также ускоряет реакции типа SE2, тогда как на реакции типа SEi влияет гораздо меньше. Большое влияние оказывает природа электрофуга: в случае карбкатионных электрофуюв наблюдается механизм SE1, тогда как для металлсодержащих — SE2 или SE i.
Заместители в субстрате, обладающие отрицат. индуктивным и мезомерным эффектами, ускоряют реакции типа SE1. Реакции типа SE2также ускоряются при наличии заместителей, обладающих отрицат. индуктивным эффектом, и замедляются при наличии заместителей с положит. индуктивным эффектом. Так, относит. скорость изотопного замещения ртути CH3HgX + Hg*X2 CH3Hg*X + HgX2 возрастает в 8 раз при переходе от Х = Br к Х = 1 и в 240 000 раз при переходе от X = OCOCH3 к X = NO2.
CH3Hg*X + HgX2 возрастает в 8 раз при переходе от Х = Br к Х = 1 и в 240 000 раз при переходе от X = OCOCH3 к X = NO2.
В некоторых случаях электроф. замещение может сопровождаться перегруппировками углеродного скелета молекулы. Например, бензиновые эфиры при действии литийорг. агентов изомеризуются в спирты (перегруппировка Виттига):
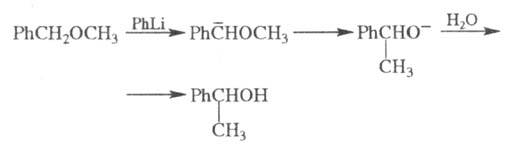
Для аммониевых солей характерна Стивенса перегруппировка. Описаны также электроф. перегруппировки Клайзена, Фриса и др.
Один из важнейших типов реакций в орг. химии — электроф. замещение в ряду ароматич. со ед.; последние благодаря наличию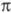 -системы легко создают центры с повышенной электронной плотностью. К таким реакциям относят нитрование, нитрозирование, ацилирование по Фриделю-Крафтсу и др.
-системы легко создают центры с повышенной электронной плотностью. К таким реакциям относят нитрование, нитрозирование, ацилирование по Фриделю-Крафтсу и др.
В начальной стадии электрофил Y+ образует с ароматич. субстратом промежут. комплекс (I). Обычно считают, что для ароматич. соед., активированных электронодонорными заместителями, структура (I) соответствует -комплексу, в котором Y* расположен над плоскостью кольца (впервые концепция
-комплексу, в котором Y* расположен над плоскостью кольца (впервые концепция — комплексов в Э. р. была выдвинута М. Дьюаром в 1946):
— комплексов в Э. р. была выдвинута М. Дьюаром в 1946):
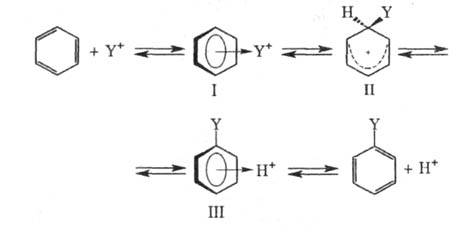
Образование -комплекса, как правило, характеризуется очень высокими скоростями (до 1010 с−1). Лимитирующая стадия — формирование циклогексадиенильного катиона (П), т. наз.
-комплекса, как правило, характеризуется очень высокими скоростями (до 1010 с−1). Лимитирующая стадия — формирование циклогексадиенильного катиона (П), т. наз.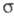 -комплекса (комплекса Уэланда, или аренониевого иона), либо, реже, распад II через промежуточный π-комплекс III (см. также рис.). Образование σ-комплексов доказано в некоторых газофазных реакциях электроф. замещения с помощью радиохим. методов, масс-спектрометрии и ион-циклотронного резонанса; в условиях высокого вакуума σ-комплексы м. б. достаточно устойчивыми. Из растворов препаративно выделены соли ряда катионов II. При использовании высокореакционноспособных реагентов лимитирующей стадией может стать стадия образования π-комплекса.
-комплекса (комплекса Уэланда, или аренониевого иона), либо, реже, распад II через промежуточный π-комплекс III (см. также рис.). Образование σ-комплексов доказано в некоторых газофазных реакциях электроф. замещения с помощью радиохим. методов, масс-спектрометрии и ион-циклотронного резонанса; в условиях высокого вакуума σ-комплексы м. б. достаточно устойчивыми. Из растворов препаративно выделены соли ряда катионов II. При использовании высокореакционноспособных реагентов лимитирующей стадией может стать стадия образования π-комплекса.
В реакциях электроф. замещения монозамещенных производных бензола новая группа вступает в орто-, мета- или пара-положение; при этом заместители либо облегчают, либо затрудняют протекание реакции. По правилам ориентации заместители, проявляющие положит. индуктивный эффект (+I) и положит. мезомерный эффект (+М), активируют ароматич. ядро и являются орто- или пара-ориентантами. Заместители, проявляющие -I и +М-эффекты, также орто- или пара-ориентанты; однако, в случае когда индуктивный эффект больше мезомерного (напр., у Hal), ароматич. ядро пассивируется, если же индуктивный эффект меньше мезомерного (OR, SR, NR2 и др.), — ядро активируется. Заместители, проявляющие -I и -М-эффекты (CN, NO2), пассивируют ядро и являются мета-ориентантами (см. табл.). По иной классификации орто- и пара-ориентанты относят к заместителям I рода, а мета-ориентанты — к заместителям II рода. Причина разл. реакц. способности орто-, мета- и пара-положений — изменение распределения электронной плотности в кольце под влиянием заместителей.
КЛАССИФИКАЦИЯ ЗАМЕСТИТЕЛЕЙ В АРОМАТИЧЕСКОМ ЯДРЕ В ЭЛЕКТРОФИЛЬНЫХ РЕАКЦИЯХ
таблица в процессе добавления
Соотношение орто-, мета- и пара-изомеров в продуктах реакции зависит от природы электроф. агента. Так, при хлорировании толуола образуется до 75% орто-производного, а при меркурировании — до 80% пара-замещенного продукта.
Для количеств, характеристики ориентирующего влияния заместителей используют факторы парциальной скорости (ФПС), т. е. скорости замещения в определенное положение ароматич. ядра относительно скорости замещения в одно положение бензола. ФПС выражают через константы скорости по всем положениям для замещенного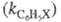 и незамещенного
и незамещенного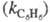 продуктов и долю каждого изомера (z) в процентах:
продуктов и долю каждого изомера (z) в процентах: 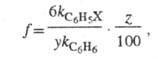
где у — число эквивалентных положений (для орто- и меma-изомеров у = 2, для пара-изомера у = 1).
Для эксперим. определения ФПС используют конкурирующее замещение в смеси C6H6 и C6H5Х при действии к.-л. электрофила. Возникающая смесь продуктов анализируется с определением орто-, мета- и пара-замещенных типа YC6H4X, а также производного бензола YC6H5.
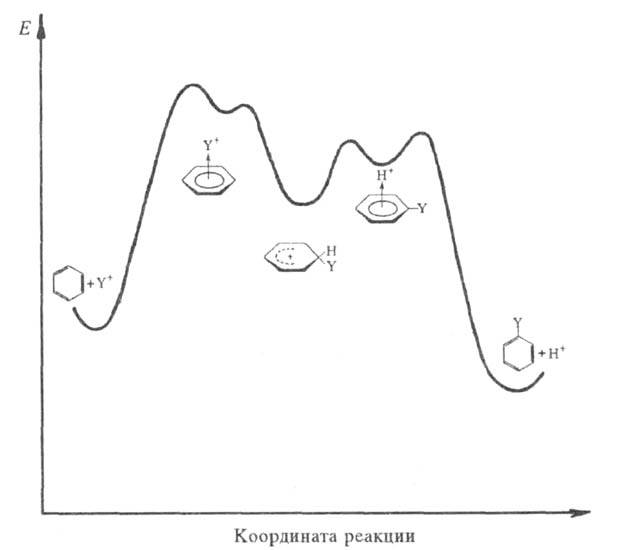
Схематич. изображение изменения энергии системы в реакциях электроф. замещения в ароматич. ядре.
Электроф. замещение в ароматич. ряду подчиняется уравнению Гаммета (см. корреляционные соотношения). Однако последнее неприменимо для opmo-положений, поскольку не учитывает пространств. факторы. Используя электроф. константы заместителей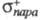 и
и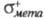 , можно вычислить парциальные скорости образования пара- и мета-изомеров:
, можно вычислить парциальные скорости образования пара- и мета-изомеров:
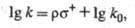
ще k и k0- константы скорости образования пара(мета)-изомера монозамещенного бензола и незамещенного бензола соответственно.
Для характеристики селективности электрофила по отношению к субстрату используют фактор селективности (Sf), который определяют по уравнению:
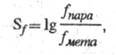
где fпара и fмета — ФПС для пара- и мета-замещения ароматич. соед. В реакциях галогенирования и ацилирования по Фриделю-Крафтсу проявляется высокая селективность злектрофила по отношению к субстрату, протонирование и нитрование занимает промежут. положение, а алкилирование по Фриделю-Крафгсу малоселективно.
Весьма распространены реакции электроф. присоединения к двойной и тройной связи С — С (АdЕ-реакции). Как правило, эти процессы рассматривают как двухступенчатые, на лимитирующей стадии которых образуется катионоидный интермедиат (ионный путь а):
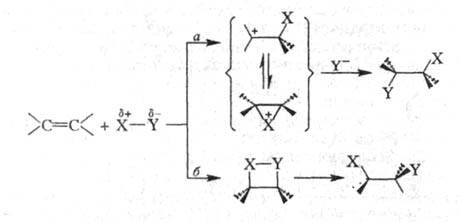
В некоторых случаях (напр., при взаимодействии олефинов с BR3, HHal и др.) присоединение может осуществляться по мол. механизму (путь б).
Во мн. случаях реакции AdE идут стереоселективно (напр., присоединение галогенов приводит к анти-аддуктам). Электроф. присоединение полярных молекул к алкенам и алкинам протекает по Марковникова правилу и Зайцева-Вагнера правилу.
Лит.: Реакционная способность и пути реакции, пер. с англ., М., 1977; Смит В. А., "Изв. Сиб. отд. АН СССР", сер. хим. н., 1980, в. 3, № 7, с. 128–38; Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., М., 1981; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 314-^55; Минкин В. И., Снмкнн Б. Я., Миняев P.M., Квантовая химия органических соединений. Механизмы реакций, М., 1986; Марч Дж., Органическая химия, пер. с англ., т. 2, М., 1987, с. 304–502; Агрономов А. Е., Избранные главы органической химии, 2 изд., М., 1990; Шабаров Ю. С., Органическая химия, т. 1–2, М., 1994.
М. Е. Клецкий
Значения в других словарях
- ЭЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ — ЭЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ — осуществляются между молекулой органического соединения и электрофилом (катионом или молекулой, имеющей центр с пониженной электронной плотностью) — напр.: C6H6 + NO2+ C6H5NO2 + H+. Относятся к гетеролитическим реакциям. Большой энциклопедический словарь
